![图片[1]-化学仿制药药学研发常用指导原则汇总-药研库](https://pharmlibrary.com/wp-content/uploads/2024/12/药学研发法规汇总.png)
本文转自药研日记
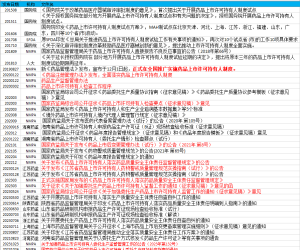
1.注册
- 《仿制药质量和疗效一致性评价受理审查指南(征求意见稿)》
- 《化学原料药受理审查指南(征求意见稿)》
- 《化学药品3类注册申请药学自评估报告(制剂)(征求意见稿)》
- 《化学药品3类注册申请药学自评估报告(原料药)(征求意见稿)》
- 《化学药品注册受理审查指南修订稿(征求意见稿)》(花脸稿)
- 《化学药品非处方药上市注册技术指导原则(征求意见稿)》
- 《境外已上市境内未上市化学药品药学研究与评价技术要求(征求意见稿)》
- 《已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(化学药品)(征求意见稿)》政策解读
- 《放射性化学仿制药药学研究技术指导原则(征求意见稿)》
- 《新批准上市以及通过仿制药质量和疗效一致性评价的化学药品目录集》收载程序和要求(试行)(征求意见稿)
- 《药品审评审批信息公开管理办法(征求意见稿)》
- 《药品审评过程中有因检查启动工作程序》(征求意见稿)
- 《药品注册核查检验启动原则和程序管理规定(试行)》(征求意见稿)
- 《药审中心补充资料管理规范(征求意见稿)》
- 《药物研发与技术审评沟通交流管理办法(征求意见稿)》
- 化学仿制药参比制剂遴选申请资料要求(征求意见稿)
- 化学仿制药注册批生产规模的一般性要求
- 化学药品注册分类及申报资料要求
- 化学药物制剂研究基本技术指导原则
- 化学药物质量标准建立的规范化过程
- 境外已上市境内未上市化学药品药学研究与评价技术要求(试行)
- 境外生产药品上市后备案类变更办理程序和要求(征求意见稿)
- 已在境内上市的境外生产药品转移至境内生产药品上市注册申请申报资料要求(化学药品)(征求意见稿)
- 药包材登记资料要求(征求意见稿)
- 药品注册研发生产主体合规信息管理与审查指导原则(试行)
- 药品附条件批准上市技术指导原则(试行)
- 药用辅料登记资料要求(征求意见稿)
2.资料撰写
- 化学仿制药电子通用技术文档申报指导原则(征求意见稿)
- 化学药品说明书及标签药学相关信息撰写指导原则(试行)
- 抗肿瘤药物说明书安全性信息撰写技术指导原则
- 抗菌药物说明书技术指导原则
- 药品电子通用技术文档结构(征求意见稿)
- 药品电子通用技术文档(eCTD)实施指南V1.0
- 药品电子通用技术文档(eCTD)技术规范V1.0
- 药品电子通用技术文档(eCTD)验证标准V1.0
《M4:人用药物注册申请通用技术文档(CTD)》模块一及CTD中文版
M4(R4)中文版
M4E中文版
M4Q中文版
M4S中文版
M4模块一文件
3.变更
- 《〈已上市化学药品药学变更研究技术指导原则(试行)〉原料药变更的问答》(征求意见稿)
- 《药品变更受理审查指南(征求意见稿)》修订说明
- 已上市化学药品变更研究的技术指导原则(一)
- 已上市化学药品生产工艺变更研究技术指导原则
- 已上市化学药品药学变更研究技术指导原则(试行)
- 已上市化学药品药学变更研究技术指导原则(试行)溶出曲线研究的问答
4.临床
- 《化学仿制药生物等效性研究摘要(征求意见稿)》
- 《化学药品创新药Ⅲ期临床试验前会议药学共性问题及相关技术要求(征求意见稿)》
- 《化学药品改良型新药临床试验技术指导原则问与答(征求意见稿)》
- 《境外已上市境内未上市经口吸入制剂仿制药临床试验技术指导原则(公开征求意见稿)》
- 《安全性参考信息示例(征求意见稿)》
- 《局部给药局部起效药物临床试验技术指导原则(征求意见稿)》
- 《新药研发过程中食物影响研究技术指导原则(征求意见稿)》
- 《生物等效性研究的统计学指导原则(征求意见稿)》
- 《研究者手册中安全性参考信息撰写技术指导原则(征求意见稿)》
- 《组织患者参与药物研发的一般考虑指导原则(征求意见稿)》
- 《高变异药物生物等效性研究技术指导原则(征求意见稿)》
- 药品审评中心药物临床试验期间安全信息评估与风险管理工作程序(试行)修订稿(征求意见稿)
- 风险分析与管理计划撰写指导原则(征求意见稿)
5.质量研究
6.分剂型指导原则
6.1注射剂
- 《化学药品注射剂配伍稳定性药学研究技术指导原则(征求意见稿)》
- 化学仿制药注射剂过量灌装研究技术指导原则
- 化学药品与弹性体密封件相容性研究技术指导原则(试行)
- 化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)
- 化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)
- 化学药品注射剂仿制药质量和疗效一致性评价技术要求
- 化学药品注射剂仿制药质量和疗效一致性评价申报资料要求
- 化学药品注射剂包装系统密封性研究技术指南(试行)
- 化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)
- 化学药品注射剂生产所用的塑料组件系统相容性研究技术指南(试行)
- 化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求
- 无菌工艺模拟试验指南(无菌制剂)
- 除菌过滤技术及应用指南
6.2口服固体
- 2型糖尿病口服药物复方制剂研发指导原则
- 《咀嚼片(化学药品)质量属性研究技术指导原则(征求意见稿)》
- 《微型片剂(化学药品)药学研究技术指导原则(征求意见稿)》
- 《阿片类口服固体仿制药防滥用药学研究技术指导原则(征求意见稿)》
- 人体生物等效性试验豁免指导原则
- 以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则
- 仿制药质量与疗效一致性评价工作中改剂型药品(口服固体制剂)评价一般考虑
- 仿制药质量和疗效一致性评价工作中改规格药品(口服固体制剂)评价一般考虑
- 化学仿制药口服片剂功能性刻痕设计和研究技术指导原则(试行)
- 化学仿制药口服调释制剂乙醇剂量倾泻试验药学研究技术指导原则
- 化学仿制药晶型研究技术指导原则(试行)
- 化学药物制剂人体生物利用度和生物等效性研究技术指导原则
- 化学药物口服缓释制剂药学研究技术指导原则
- 化药口服固体制剂混合均匀度和中控剂量单位均匀度研究技术指导原则(试行)
- 化药口服固体制剂连续制造技术指导原则(试行)
- 口服固体制剂溶出度试验技术指导原则
- 口服缓释制剂体内外相关性研究技术指导原则
- 对我国《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》中关于多规格豁免BE药学评价标准“处方比例相似性”相关问题的问答(试行)
- 普通口服固体制剂溶出度试验技术指导原则
- 普通口服固体制剂溶出曲线测定与比较指导原则
- 药物溶出度仪机械验证指导原则
6.3口服溶液
6.4滴眼剂
6.5外用制剂
6.6吸入制剂
7.儿童用药
- 儿童用药口感设计与评价的技术指导原则(试行)
- 儿童用药(化学药品)药学开发指导原则(试行)
- 化学药品和治疗用生物制品说明书中儿童用药相关信息撰写的技术指导原则(试行)
- 成人用药数据外推至儿科人群的定量方法学指导原则(试行)
- 药审中心关于已上市药品说明书增加儿童用药信息工作细则(征求意见稿)
注:本文转自网络,已注明出处,如侵权请联系删除。
© 版权声明
文章版权归作者所有,未经允许请勿转载。
THE END
喜欢就支持以下吧











- 最新
- 最热
只看作者