![图片[1]-药学研究试验记录的书写要求](https://pharmlibrary.com/wp-content/uploads/2021/10/notebook-1.jpg)
国内相关法规
- 2000年-药品研究实验记录暂行规定-CFDA
- 2011年-药品研究实验记录规范性指南(试行)天津药监局药品审评中心
- 2014年-1.药品注册研制现场核查常见问题药学研究原始记录分析_田晓娟-CDE
- 2020年-国家药监局关于发布药品记录与数据管理要求(试行)-NMPA
- 2020年-科研实验室良好规范GB_T_27425-2020
各药监机构的数据完整性法规要求:
FDA#2003#Guidance for Industry 21 Part11
ISPE#201607#Draft#ispe_gamp_draft_gpg_june_2017
PIS C#20160810#Draft#PI_041_1_Draft_2_Guidance_on_Data_Integrity
WHO 数据完整性指南:良好的数据和记录规范
APIC 数据完整性指南-Data_Integrity_Best_Practices_Guide_for_API_FINAL_March-2019
记录的基本要求
ALCOA+CCEA
Attributable A 可追溯的 记录可追溯
Legible L 清晰的,可见的 清晰可见
Contemporaneous C 同步的 与操作同步生成/录入
Original O 原始的 第一手收据,未经转手的
Accurate A 准确的 与实际操作相一致的,无主观造假或客观输入错误
Complete C 完整的 无遗漏
Consistent C 一致的 与实际生成逻辑顺序一致,显示的记录人同实际操作者一致
Enduring E 长久的,耐受的 原始数据长久保存,不易删除,丢弃
Available A 可获得的 数据在审计时可见,不被隐藏
研发记录的基本要素
实验日期/实验人员
实验名称/实验目的
实验设备
实验物料耗材
实验步骤
实验结果
实验结论
实验名称/实验目的、实验步骤、实验结果、实验结论应当详细描述
记录的分发
记录分发应当受控,实验记录本和模板记录均应受控。实验原始记录是研发阶段最重要的记录,所以受控形式应该从严。其他研发类型的记录可根据记录的类型和风险的级别制定不同的控制策略。
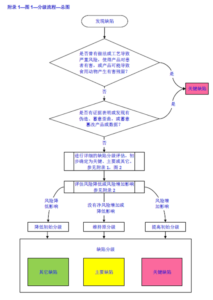
记录的复核审核
记录复核
记录应在研发部门内部进行复核,建议由部门记录人员的上级进行复核。部门上级复核的意义在于:
1)作为实验人员的上级,能够监督实验人员的记录完成情况。
2)把控实验进度,进行一定的技术性复核。
记录审核
记录审核一般由QA进行,审核的内容包含:
1)记录间的相关性(原始记录和辅助记录间的一致性)
2)涉及管理文件的符合性(记录是否符合公司文件的要求)
3)记录的完整性/合规性
记录的存档
研发的各类关键记录应当在申报注册或者申请上市获得药监部门的批准前应妥善保存,人员离职前应该确认记录笨本的领用和保存情况,记录规范性的二次确认。
研发实验记录的法规符合性
法规要求为最低要求,不可套用一个法规文件中的一条描述以偏概全,需整体评估。
研发原始记录是公司和个人知识的财富,应当及时完整的记录,有些公司将实验获得的结论等以周汇报,月度汇报PPT等其他非受控的方式体现,而此类文件没有纳入质量管理体系,不利于文件生命周期的管理。待人员离职或者项目管理文件不当会导致影响项目申报进度和公司财产损失。
总结
研发企业应当把研发记录作为研发管理的重中之重,让研发人员意识到记录的重要性,分配足够的资源对记录进行周期性复核和审查,保障研发记录的完整性和合规性。












- 最新
- 最热
只看作者