1 篇首语
2019年1月1日,PIC/S(国际药品认证合作组织)发布了PI040-1 Guidance on Classification of Deficiencies,该指南的目的:
(1) 确保GMP缺陷的分类与缺陷的潜在风险相一致,保持不同检查员之间的一致
(2) 提高GMP缺陷的识别、调查和纠正的效率
(3) 对检查机构提出针对发现严重缺陷和主要缺陷时需采取的措施
(4) 促进监管机构和制药企业之间对GMP缺陷的理解和沟通
(5) 在互信伙伴间共享检查不合规缺陷,尤其是在后续可能采取法规行动时,将有助于其它领土的药监机构制订市场风险降低措施。
2 文件学习
2.1 PIC/S缺陷分类
指南中,PIC/S检查缺陷分为以下几类:
2.1.1 关键缺陷:
(1) 已造成或将导致生产出对人体或动物患者有害的产品,或导致食用动物具有有害残留的产品的严重风险的缺陷。
(2) 在发现生产商伪造、歪曲或篡改药品或数据时亦成为“关键”缺陷。
(3) “关键”缺陷可包含几个相关缺陷,其中任何一个可能单独时都不是“关键”,但合在一起则成为“关键”缺陷;或者是当发现一个系统有受损风险,理当如此解释并报告时亦成为“关键”缺陷。
2.1.2 主要缺陷:
(1) 已生产或可能生产出不符合其上市许可、临床试验批件、药品质量标准、药典要求或注册资料的产品;
(2) 不能确保有效实施所需GMP控制措施;
(3) 显示严重偏离生产许可的条款;
(4) 显示批放行或(在PIC/S内)未能执行令人满意的程序,或授权人未能履行其职责;
(5) 包括几个“其它”相关缺陷,其中任何一个单独可能都不是“主要”,但在一起则成为“主要”缺陷,或者是系统失败且应按“主要缺陷”解释或报告。
2.1.3 其它缺陷:
(1) 一个缺陷不能分级为“关键”或“主要”,但显示出偏离GMP要求。
(2) 如果没有足够的信息将一个缺陷分级为“关键”或“主要”,则可能判定为“其它”。
2.1.4 建议:
(1) 一次性轻微偏差通常并不会正式成为缺陷,但会作为建议提醒生产商注意。
2.2 国内缺陷分类
根据国内《药品生产现场检查风险评定指导原则》(CFDA,2014年05月),国内GMP检查的缺陷分为如下三类:
2.2.1 关键缺陷:
严重缺陷是指与药品GMP要求有严重偏离,产品可能对使用者造成危害的缺陷。属于下列情形之一的为严重缺陷:
(1) 对使用者造成危害或存在健康风险;
(2) 与药品GMP要求有严重偏离,给产品质量带来严重风险;
(3) 有文件、数据、记录等不真实的欺骗行为;
(4) 存在多项关联主要缺陷,经综合分析表明质量管理体系中某一系统不能有效运行。
2.2.2 主要缺陷:
主要缺陷是指与药品GMP要求有较大偏离的缺陷。属于下列情形之一的为主要缺陷:
(1) 与药品GMP要求有较大偏离,给产品质量带来较大风险;
(2) 不能按要求放行产品,或质量受权人不能有效履行其放行职责;
(3) 存在多项关联一般缺陷,经综合分析表明质量管理体系中某一系统不完善。
2.2.3 一般缺陷:
(1) 一般缺陷是指偏离药品GMP要求,但尚未达到严重缺陷和主要缺陷程度的缺陷。
通过上述两份文件的对比发现,国内的分级和PIC/S的分级比较类似,只不过PICS额外增加了建议项。
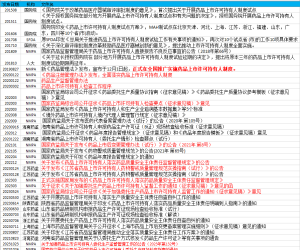
2.3 GMP缺陷分类管理工具
PI 040-1指南附录1提供了符合风险管理原则的支持GMP缺陷统一客观分类的管理工具,这是目前制定比较全面也是比较合理的工具,见下图。
![图片[1]-法规学习-PI040-1 PIC/S GMP缺陷分级指南-药研库](https://pharmlibrary.com/wp-content/uploads/2024/04/image.png)
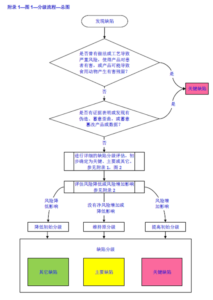
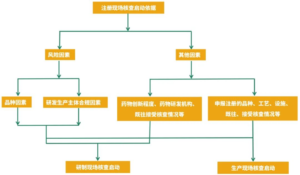
对于详细的分级流程,指南进一步进行了阐明
![图片[2]-法规学习-PI040-1 PIC/S GMP缺陷分级指南-药研库](https://pharmlibrary.com/wp-content/uploads/2024/04/image-1.png)
![图片[3]-法规学习-PI040-1 PIC/S GMP缺陷分级指南-药研库](https://pharmlibrary.com/wp-content/uploads/2024/04/image-2.png)
![图片[4]-法规学习-PI040-1 PIC/S GMP缺陷分级指南-药研库](https://pharmlibrary.com/wp-content/uploads/2024/04/image-3.png)
2.4 风险的升级/降级
指南对于评估工具中描述的风险增加或降低因素在附录2进行了解释。
2.4.1 风险升级
当存在满足升级风险分级定义的条件时,“主要”和“其它”缺陷可分别上升一个级别至“关键”或“主要”缺陷。风险增加因素包括:
(1) 反复或重新发生缺陷
(2) 组合或合并缺陷
(3) 产品风险(可升级或降级)
(4) 生产商管理中未能识别和采取谨慎措施降低受到有缺陷做法或工艺影响的已销售产品和未来生产中的患者风险至可接受水平
2.4.2 风险降级
当存在满足降级风险分级定义的条件时,“关键”和“主要”缺陷可分别降低一个级别至“主要”或“其它”缺陷。风险降低因素包括:
(1) 将产品风险降至最小
(2) 将患者伤害风险降至最小
(3) 如果有证据支持其它风险降低因素
(4) 生产商所采取的措施,例如降低缺陷风险的CAPA计划
指南中还对常见的一些缺陷进行了举例,详细可以查看原文。国内的《药品生产现场检查风险评定指导原则》(CFDA,2014年05月)也提供了一些缺陷分级的案例。
3 总结
国内检查报告中缺陷的分级实施感觉目前并没有严格按照《药品生产现场检查风险评定指导原则》,这里面感觉有时候是因为“江湖因素”,有些时候检查老师甚至被企业裹挟。2023年11月,PIC/S致函国家药监局NMPA,确认国家药监局正式申请者身份。如果正式加入PIC/S,必然推动检查结果的互认,报告分级的严谨准确必然作为PIC/S成员国所应该做到的。
4 参考文献
PI 040-1 GUIDANCE ON CLASSIFICATION OF GMP DEFICIENCIES, PIC/S(2019.10)
《药品生产现场检查风险评定指导原则》,CFDA(2014年05月)
基于《PIC/S GMP 缺陷分级指南》的药品生产质量管理规范检查缺陷分级研究,颜若曦,CDE(2023年6月)













Mark2年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者3年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。