包含"合规"的全部内容
国家药品抽检年报(2023)解读
2024年3月26日,中检院发布了《国家药品抽检年报(2023)》,报告中展示了2023年我国药品抽检工作取得了成果。报告中显示, 2023年共完成了132个品种18762批次制剂产品与中药饮片的抽检任务,涉...
法规学习-PI040-1 PIC/S GMP缺陷分级指南
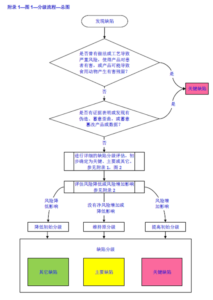
1 篇首语 2019年1月1日,PIC/S(国际药品认证合作组织)发布了PI040-1 Guidance on Classification of Deficiencies,该指南的目的: (1) 确保GMP缺陷的分类与缺陷的潜在风险相一致,保...






Mark2年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者3年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。