2024年02月23日江苏省局《推动企业落实质量安全主体责任的激励和约束措施管理规定》(试行)(征求意见稿),具体内容大家可以在官网查看,我们主要来分析下这个文件的影响。
此次规定明确了企业质量安全主体责任激励和约束机制的具体内容,有助于强化企业质量安全意识,促使企业主动履行主体责任。此规定适用于研制/生产/经营等企业,目的应该是强化药品生命周期的监管激励和约束。上期我们说到,132号文后药监对纯B证企业的监管层层加码,详见药品上市许可持有人制度的思考- B证的尽头是A证?这次规定总算没有特别关照B证药品生产企业。
此次规定的条款中
第五条 各级药品监督管理部门职能监管处室应当对企业落实质量安全主体责任进行年度评估,按照评估体系评出A、B、C三级。
通过对相关主体的分级,制定不同的激励和约束措施,其中
第六条 对评估结果为A级的企业,药品监督管理部门可以在权限范围内给予下列激励:
(一)在行政许可、确认、备案等政务服务中,给予容缺受理、快速办理(含检验检测、核查、审评等)便利;
(二)在日常监督管理和专项检查中,合理降低抽查比例、减少检查频次或内容;
(三)在医药产业科技创新中,同等条件下给予重点支持;
(四)在药品安全信用评价中,予以加分;
(五)对充分履行主体责任仍出现非主观因素所致的违法行行为,视情形减轻或者免予行政处罚;
(六)其他依法可以给予的激励。
第七条 对评估结果为C级的企业,药品监督管理部门可以在权限范围内给予下列约束:
(一)依法约谈企业的法定代表人、主要负责人或者其他负责人员,指出问题、明确要求、督促整改;
(二)在日常监督管理和专项检查中,列为重点监督管理对象,提高抽查比例、增加检查频次,加强现场检查;
(三)在药品安全信用评价中,予以减分;
(四)发生违法行为的,依法从严处理;
(五)其他依法可以给予的约束。
第八条 药品监督管理部门应当在评估结果明确后的二十个工作日内告知企业可以享受的激励措施和可能受到的约束措施。实施激励措施后,企业发生重大违法行为或者因药品质量安全造成重大社会影响的,药品监督管理部门应当及时停止实施。
值得注意的是,本规定的预期生效日期应该在2024年底前(参见第十条)
解读
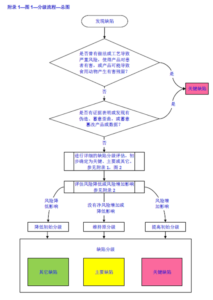
本规定发布前,监管机构对相关企业的监管例如现场核查基于风险管理,结合一些风险因素进行综合判定,见下图。
![图片[1]-江苏省局发布《推动企业落实质量安全主体责任的激励和约束措施管理规定》(试行)(征求意见稿)解读-药研库](https://pharmlibrary.com/wp-content/uploads/2024/03/image.png)
本规定发布后,不仅仅适用于日常监督管理和专项检查,还会影响到行政许可的受理,科技创新的支持以及违法行为的判罚。以往一些企业可能会认为质量管理只会增加企业运营的成本,而本文件的目的就是给企业明确的指引,监管方对于那些质量管理比较优秀的企业需要进行一定的激励,而对于做的比较差的需要进行处罚约束。
江苏药品研制生产和经营企业,你们准备好应对新规了吗?











Mark2年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者3年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。