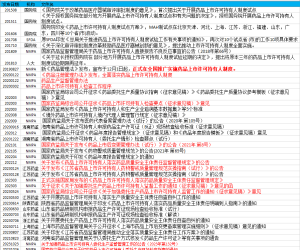
![图片[1]-MAH最新监管方向-文献《我国药品上市许可持有人(MAH)制度实施路径问卷调研与结果分析》的思考-药研库](https://pharmlibrary.com/wp-content/uploads/2024/05/image-4-1024x346.png)
今天我们来看一篇发表于《中国食品药品监管杂志》的文献,文献主要内容是由沈阳药科大学亦弘商学院组织开展“我国药品上市许可持有人制度实施路径研究”课题研究。通过对我国MAH 制度落地实施过程中的主要问题进行梳理,结合MAH 制度试点期间的经验总结,以及对欧盟、美国、日本等国家和地区MAH 监管体系的深入研究,设计调研问卷,开展定向问卷调研,并对调研结果进行分析,为提出完善我国MAH 制度落地实施建议提供支持。
文献调研对象为我国药品研发、注册、生产、监管等领域从业人员。调研问卷主要通过微信形式发放。本次调研回收问卷共计454 份。调研对象中,44.71% 来自药品生产企业,18.28% 来自药品监管机构,17.40% 来自药品研发机构,其他约20% 来自医药合同研发生产组织(CDMO)、医药合同研发组织(CRO)、临床试验机构及其他(包括药品经营企业,销售、教育机构或社团等)。
从调研的对象来看具有很强的代表性,且监管机构也列在调研对象中,使得调研的结果更具参考价值。
对于调查结果符合预期的本文不再讨论,本文关注几个在笔者看来值得思考的调研内容与大家分享下。
其一
![图片[2]-MAH最新监管方向-文献《我国药品上市许可持有人(MAH)制度实施路径问卷调研与结果分析》的思考-药研库](https://pharmlibrary.com/wp-content/uploads/2024/05/image.png)
作为以前在多个集团性公司就职的人来说,我看待这个问题觉得需要三个角度来思考。
- 从公司的角度来说,为了降低成本,质量资源在多个实体之间共用和调配无疑能降低成本,那么从企业角度来说这么高的支持率无疑是有利的。当然企业最终是否获益不能单一从成本考虑,还需要考虑其他因素。
- 从就职于集团性公司的质量管理人员来说,我觉得共用资源是某些甚至很多情况下不利于工作顺利开展的。质量管理人员可能会失去其履行其职责的能力,被迫做出很多妥协。此外过程伴随着职责不明确,各公司间的推诿扯皮。而且公用质量资源,也有可能的实际情况是双方的资源都不够用,公用资源导致的结果是资源的进一步不足,最终可能导致质量安全事故的发生。
- 从监管机构的角度来说,68.75%的认可率只是稍低于整体水平让我是有点惊讶的。一方面监管方能够兼顾企业的实际运行情况是值得肯定的,另一方面不知道监管机构能否剖析洞察在每次核查过程中企业表现出的完善质量文化背后的刀光剑影。
其二
![图片[3]-MAH最新监管方向-文献《我国药品上市许可持有人(MAH)制度实施路径问卷调研与结果分析》的思考-药研库](https://pharmlibrary.com/wp-content/uploads/2024/05/image-1.png)
对于这个结果也是比较奇怪,我觉得66%的人建议API实施MAH制度太低了,究竟是什么原因导致原料药无法实施MAH制度,我们到现在也没听到一个合理的解释,毕竟国外已经实施了很久了。
其三
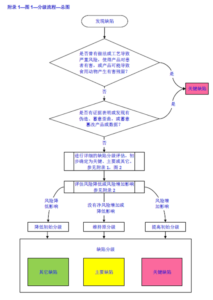
上市后维护(上市后研究、变更、再注册)
![图片[4]-MAH最新监管方向-文献《我国药品上市许可持有人(MAH)制度实施路径问卷调研与结果分析》的思考-药研库](https://pharmlibrary.com/wp-content/uploads/2024/05/image-2.png)
此部分提出的意见非常有意义!能够落地会更好。
其四
![图片[5]-MAH最新监管方向-文献《我国药品上市许可持有人(MAH)制度实施路径问卷调研与结果分析》的思考-药研库](https://pharmlibrary.com/wp-content/uploads/2024/05/image-3.png)
大部分认为应在省级机构制定,但是不同的省份制定的要求差异较大,导致持有人与受托方不在同一省份的情况存在监管困难的情况。个人觉得应统一全国的检查和工作程序,提升行业整体水平!
最后,如果是你,你想对MAH制度提出哪些问题和建议呢?
注:本文首次发表于“MAH药讯”公众号,如需可以扫码下图关注。
![图片[6]-MAH最新监管方向-文献《我国药品上市许可持有人(MAH)制度实施路径问卷调研与结果分析》的思考-药研库](https://pharmlibrary.com/wp-content/uploads/2024/05/qrcode_for_gh_2a0196b5242c_258-1.jpg)
© 版权声明
文章版权归作者所有,未经允许请勿转载。
THE END
喜欢就支持以下吧










Mark2年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者3年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。