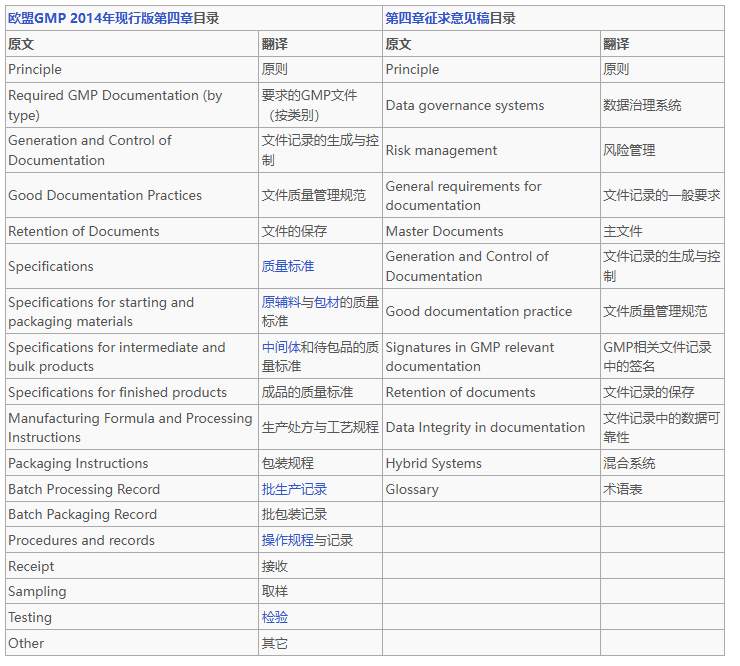
EU GMP发布第四章Documentation文件管理征求意见稿-文末附双语版下载地址
随着制药行业的不断发展,欧盟良好生产规范(EU GMP)也在持续更新,以适应技术进步和监管需求的变化。EU GMP 第四章“文件管理”是质量管理体系的核心组成部分,其修订对制药企业的合规性和运...
解读欧盟GMP附录22征求意见稿:人工智能在药品制造中的应用-附文件下载(双语)
近期,人工智能(AI)正式“入编”欧盟GMP指南! 欧盟引入了全新附录22,为药品及活性物质制造过程中AI的应用设定了明确监管标准。该附录主要关注通过机器学习(ML)实现功能的模型在关键GMP流...
QC实验室详细审计表(GMP和GLP)分享
引言 在制药、生物技术和医疗器械行业,实验室的质量管理是确保产品安全和合规性的核心。GMP(良好生产规范)和GLP(良好实验室规范)作为国际标准,指导着生产和实验过程的质量控制。为了帮...
2025年第六期“药审云课堂”-课件和培训视频分享
6月6日,CDE进行了2025年度第六期药审云培训,本期以“药品注册申报常见问题”为主题,系统展示药品注册申报流程及多层级多渠道沟通交流机制,让公众更好地了解药品审评工作,同时帮助申请人科...
化学仿制药药学研发常用指导原则汇总
本文转自药研日记 1.注册 《仿制药质量和疗效一致性评价受理审查指南(征求意见稿)》 《化学原料药受理审查指南(征求意见稿)》 《化学药品3类注册申请药学自评估报告(制剂)(...