排序
资源分享-2025年识林法规指南导航全球药监
这份文件是识林发布的 2025 年全球药监法规指南报告,聚焦中国、美国、欧盟等六大官方机构发布的 811 份高价值监管文件,围绕监管政策、非临床与临床研究、药学研究、注册与变更等 7 个药品全生...
转载-2025年CDE官方问答全梳理(截至20260109)
2025年,国家药品监督管理局药品审评中心(CDE)持续围绕药品注册申报中的关键环节、高频疑问与共性难题,发布了一系列具有指导意义的共性问题解答。为帮助业界更清晰把握政策导向、提升申报效...
202512-黑龙江药监-关于《关于修订〈黑龙江省药品上市后场地变更实施办法(试行)〉及部分条款有关事宜的通知》的政策解读
各药品上市许可持有人、药品生产企业,机关各处室、各直属单位: 2022年10月,我局出台《黑龙江省药品监督管理局药品上市后场地变更实施办法(试行)》(简称《办法》,通过优化许可检查,促...
202509-EMA-Guidelines on the details of the various categories of variation欧盟药品上市许可变更新指南(2026生效)-附下载
2026 年 1 月 15 日,欧盟《药品上市许可变更分类及流程指南》(C/2025/5045)将正式生效,替代沿用 13 年的 2013 版指南。这份经 2024 年修订的新规,通过简化流程、优化分类、强化工作共享机...
资源分享-202512-EMA-Guideline on stability testing for applications for variations to a marketing authorisation(EMA 稳定性试验变更指南)
2025 年 12 月,欧洲药品管理局(EMA)发布了修订后的《上市许可变更申请稳定性试验指南》(EMA/CHMP/QWP/441071/2011-Rev.3),该指南将于 2026 年 1 月 15 日正式生效,全面替代 2011 年版 Re...
资源分享-202512-药品注册审评缺陷研究-by zhulikou431(丁恩峰老师)
这份由丁香园 zhulikou431 (丁老师)编写的《药品注册审评缺陷研究》(R139修订本)是一部深度汇总了2010年至2025年跨度的药品注册案例集,旨在通过分析CDE(药审中心)在审评审批中提出的缺陷...
资源分享-202512-CDE-放射性药品注册核查常见问题解析-慕琰
本培训围绕放射性药品注册核查展开,解读了《药品注册管理办法》等相关文件要求,明确了正常及优先审评程序下核查的时限、现场核查流程等全流程规范,说明了研制和生产现场核查的核心要点(含关...
资源分享-202512-NIFDC-放射性药品注册检验常见问题分析-姚静
该培训围绕放射性药品注册检验展开,介绍了中检院放药实验室的发展、人员资质及承检范围,详解了《药品注册检验工作程序和技术要求规范 (2025 年修订版)》中的程序优化(如样品量减少、时限缩短...
资源分享-202512-CDE-放射性治疗药物临床审评中常见问题和考虑-仝昕
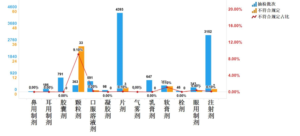
该 培训 围绕放射性治疗药物临床审评展开,介绍了其申报及审评量逐年递增、创新型产品不断涌现且全球同步研发增多的进展,呈现了全球以 SSTR、PSMA 为主要靶点,177Lu 等为主要治疗性核素,小分...
资源分享-202512-CDE-放射性化学药品非临床评价策略和关注点-赵春阳
这份培训内容围绕放射性化学药品(含诊断与治疗类,以 RDC 为主,涉及多种核素、配体 / 载体及新靶点)的非临床评价展开,涵盖我国放药研发与政策背景、相关指导原则框架,明确非临床研究需遵循...


















kidzhangy2月前0
感谢分享,楼主好人一生平安Terrific3月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。