排序
资源分享-CMDE-中国医疗器械器审中心答疑解惑汇总(202511)
医疗器械器审中心发布的 6.3 版答疑解惑汇总(2025 年 11 月 17 日),收录了 2017 年至 2025 年间的 530 个核心问题及解答,聚焦医疗器械与体外诊断试剂注册申报、临床评价、检测验证、技术要...
资源分享-202512-药品注册审评缺陷研究-by zhulikou431(丁恩峰老师)
这份由丁香园 zhulikou431 (丁老师)编写的《药品注册审评缺陷研究》(R139修订本)是一部深度汇总了2010年至2025年跨度的药品注册案例集,旨在通过分析CDE(药审中心)在审评审批中提出的缺陷...
资源分享-202512-CDE-放射性治疗药物临床审评中常见问题和考虑-仝昕
该 培训 围绕放射性治疗药物临床审评展开,介绍了其申报及审评量逐年递增、创新型产品不断涌现且全球同步研发增多的进展,呈现了全球以 SSTR、PSMA 为主要靶点,177Lu 等为主要治疗性核素,小分...
资源分享-202512-CDE-放射性化学仿制药药学审评的关注点和考虑-何艳
该培训阐述了该类药物具有放射性、定制生产或即时标记、按放射性活度给药等特殊特点,梳理了《放射性化学仿制药药学研究技术指导原则》等相关技术要求文件的制定历程及已发布、待发布情况,明确...
资源分享-202512-CDE-放射性新药要学审评中常见问题和考虑-周浩晖
该文件是药审中心化药药学一部 2025 年 12 月发布的关于放射性新药药学审评的专业指引,明确了放射性药品(用于临床诊断或治疗的放射性核素制剂或其标记药物)的发展现状(传统企业与新入局企业...
20251203-CDE重磅发布!《化学仿制药药学研究重大缺陷(试行)》征求意见稿解析-附下载
2025年12月3日,CDE发布通知,公开征求《化学仿制药药学研究重大缺陷(试行)(征求意见稿)》等文件的意见 。这份文件不仅仅是一个技术清单,更是一次审评逻辑的重大调整。核心内容在于:对于...
转载-结合近五年药品审评报告浅析药品注册申请未获批准的原因及启示
01近五年药品注册申请审评及未获批准数据分析 近五年需CDE开展技术审评的化学药品注册申请审结件数呈明显的增长趋势,具体审评情况见表1。 ▲表1-近五年需技术审评的化学药品注册申请审结...







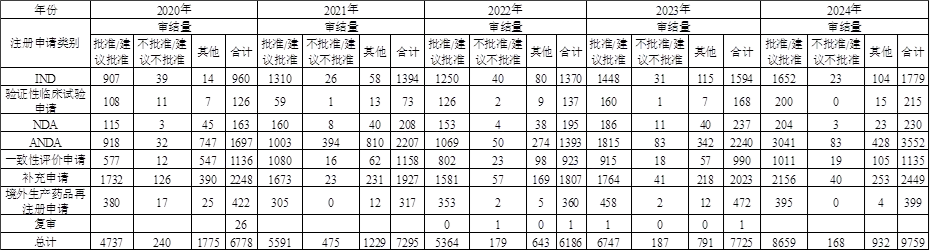









kidzhangy2月前0
感谢分享,楼主好人一生平安Terrific3月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。