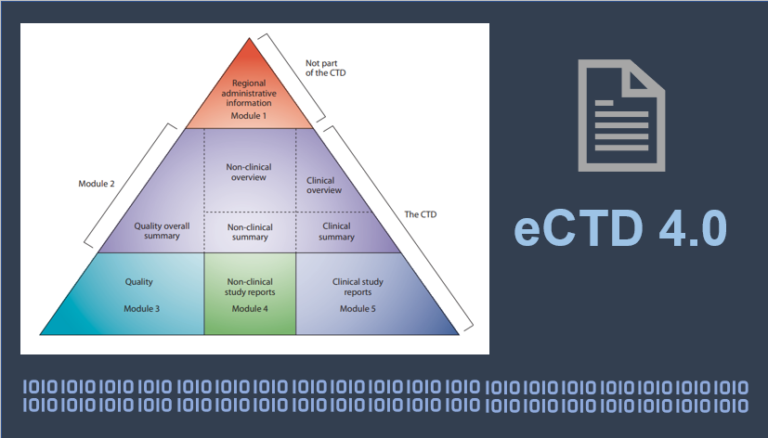
欧美日eCTD4.0即将强制实施,我们离eCTD还有多远
背景 最近看到一篇RAPS的报道,FDA和EMA的官员在DIA会上直接喊话:药企别再拖了,赶紧来试eCTD 4.0吧。感觉这事儿已经不是“未来规划”了,而是真要动真格的阶段。eCTD 4.0其实2015年就定下...
资源分享-某制药企业基于主数据数字化转型项目蓝图规划汇报方案
这份文件是某制药企业 2021 年数字化转型项目蓝图规划汇报,围绕业务流程框架、应用支撑框架等八大议程展开,聚焦寻源到付款、计划到产出、订单到收款、全面质量管理、财务管理转型等关键业务领...