排序
资源分享-2025年识林法规指南导航全球药监
这份文件是识林发布的 2025 年全球药监法规指南报告,聚焦中国、美国、欧盟等六大官方机构发布的 811 份高价值监管文件,围绕监管政策、非临床与临床研究、药学研究、注册与变更等 7 个药品全生...
2025-EMA-HUMAN MEDICINES IN 2025 (2025人用药物年度报告)-附下载
2025 年,欧洲药品管理局(EMA)交出了一份亮眼的药品监管与创新成绩单。从 104 个新药积极授权意见到罕见病治疗的突破性进展,从生物类似药的爆发式增长到全球公共卫生的跨区域协作,这一年的...
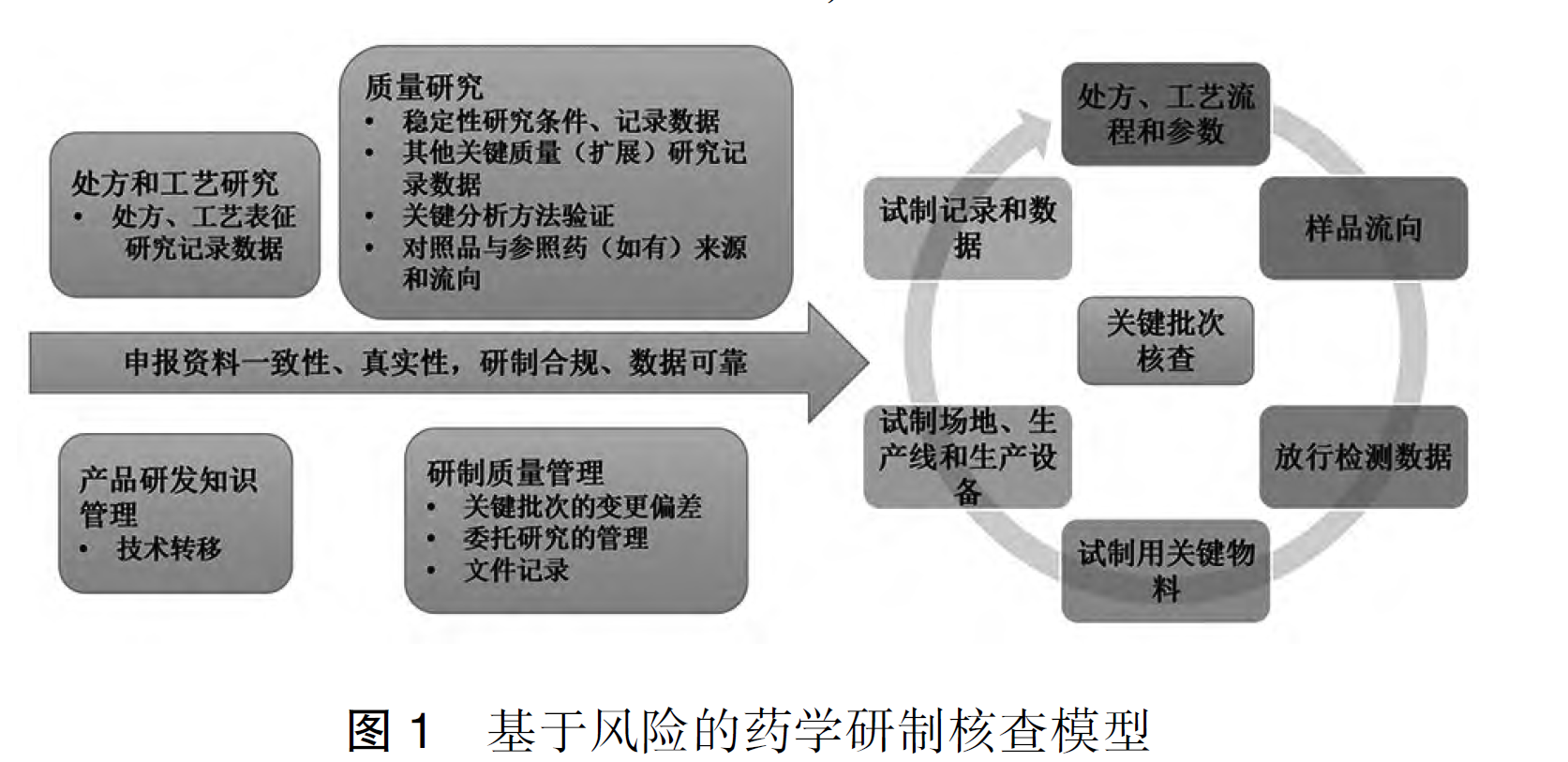
重磅文献分享-生物制品药学研制核查要点和常见问题分析(2025 CFDI 张平)-附下载
摘要 生物制品的生产和质量控制过程中,存在诸多可变性和特殊性。在新的药品注册监管法规体系下,研制现场核查是促进生物制品研发相关数据真实可追溯,推动生物制品研发行业规范和高质量发展...
202406-官方培训-药品共线生产与清洁验证专题培训班培训讲义(宁波)
该文件是国家药品监督管理局高级研修学院 2024 年 6 月宁波专题培训班的培训讲义,核心围绕《药品共线生产质量风险管理指南》展开,系统涵盖指南起草背景、核心原则(法律法规优先、持有人主责...
资源分享-某制药企业基于主数据数字化转型项目蓝图规划汇报方案
这份文件是某制药企业 2021 年数字化转型项目蓝图规划汇报,围绕业务流程框架、应用支撑框架等八大议程展开,聚焦寻源到付款、计划到产出、订单到收款、全面质量管理、财务管理转型等关键业务领...
20251231-APIC-起始物料供应商质量协议模板Quality Agreement Template for Regulatory Starting Materials ("RSMs") and Critical Materials
这份文件是 2025 年 9 月版本的 APIC(活性药物成分委员会)质量协议模板,适用于两家公司之间注册起始物料(RSMs)及关键物料的合作,共包含引言 / 目的 / 范围、一般条款、质量责任等七大部分...
转载-2025年CDE官方问答全梳理(截至20260109)
2025年,国家药品监督管理局药品审评中心(CDE)持续围绕药品注册申报中的关键环节、高频疑问与共性难题,发布了一系列具有指导意义的共性问题解答。为帮助业界更清晰把握政策导向、提升申报效...
解读 WHO 2026 版医药产品技术新规:供应商合规与质量保障指南Technical Requirements for Medicines and Health products In ITBs/RFQs-附下载
2026 年 1 月,世界卫生组织(WHO)发布了《招标 / 询价中药品和健康产品技术要求》(第 5 版),旨在通过更严格、更细致的技术规范,保障全球范围内 WHO 采购产品的质量、安全性和可及性。这份...
资源分享-DB13/T5482-2022《药品不良反应快速报告导则》
DB13/T5482-2022《药品不良反应快速报告导则》由河北药监于 2022 年 2 月 28 日发布、3 月 31 日实施,适用于药品上市许可持有人的上市后药品不良反应快速报告工作(不适用于疫苗疑似预防接种异...
资源分享-T/SHPPA 010-2025《药品生产数字化质量保证技术要求》
技术要求的亮点剖析 文件的主体是第4章“技术要求”,分为多个子部分。这里我用表格总结一下,便于大家对比和理解: 子部分主要内容亮点与影响4.1 DQA构建基本要求可访问性、可追溯性、可...


















kidzhangy3月前0
感谢分享,楼主好人一生平安Terrific4月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。