排序
资源分享-PDA TR22-2025-Process-Simulation-for-Aseptically-Filled-Products(PDA技术报告No.22(2025修订版)英文版和中英文双语版)
作为制药行业从业者一定知道无菌工艺模拟灌装在确保产品质量和患者安全方面的关键作用。PDA(Parenteral Drug Association)技术报告No.22的2025修订版,这份报告全面更新了2011版的指导原则,...
资源分享-APIC 数据完整性问答 第三版 中英文对照(Data Integrity — Frequently Asked Questions (FAQ))
在 GMP/GxP 合规领域,数据完整性(Data Integrity) 一直是监管热点。无论是 FDA、EMA 还是中国 NMPA 的检查中,数据完整性问题频频被点名,稍有不慎就可能导致警告函或停产整改。今天,我为大...
资源分享-大湾区202509药品注册生产现场核查与符合性检查衔接工作程序介绍
对于药企而言,药品注册生产现场核查与上市前 GMP 符合性检查是药品上市前的关键环节。国家层面出台的衔接工作程序,不仅明确了核查检查的核心规则,更直接影响企业的注册效率与合规成本。今天...
202509-APIC-Quality Agreement Template for Regulatory Starting Materials("RSMs") and Critical Materials-APIC更新RSM关键起始物料质量协议模板-附下载
,原料药(API)的质量安全直接关乎终端药品的疗效与患者健康,而作为 API 生产关键环节的注册起始物料(RSMs)和关键物料,其质量管控离不开规范的合作协议支撑。近日,活性药物成分委员会(AP...
资源分享-20251205-江苏药监-江苏药品委托生产现场检查常见缺陷分析(南京分中心)
江苏省药品监督管理局审评核查南京分中心于 2025 年 12 月 5 日举办的药品委托生产现场检查常见缺陷分析培训,系统梳理了药品委托生产过程中在机构与人员、共线生产管理、委托生产管理等多个关...
资源分享-202512-EMA-Guideline on stability testing for applications for variations to a marketing authorisation(EMA 稳定性试验变更指南)
2025 年 12 月,欧洲药品管理局(EMA)发布了修订后的《上市许可变更申请稳定性试验指南》(EMA/CHMP/QWP/441071/2011-Rev.3),该指南将于 2026 年 1 月 15 日正式生效,全面替代 2011 年版 Re...
资源分享-CFDI20251015注册核查数据可靠性要求与常见问题分析-张平
在生物制品行业,数据可靠性是药品研发、生产与注册的 “生命线”。无论是疫苗、抗体药还是其他生物制品,其安全性、有效性和质量可控性都依赖全生命周期数据的真实、完整与可追溯。国家药监局...
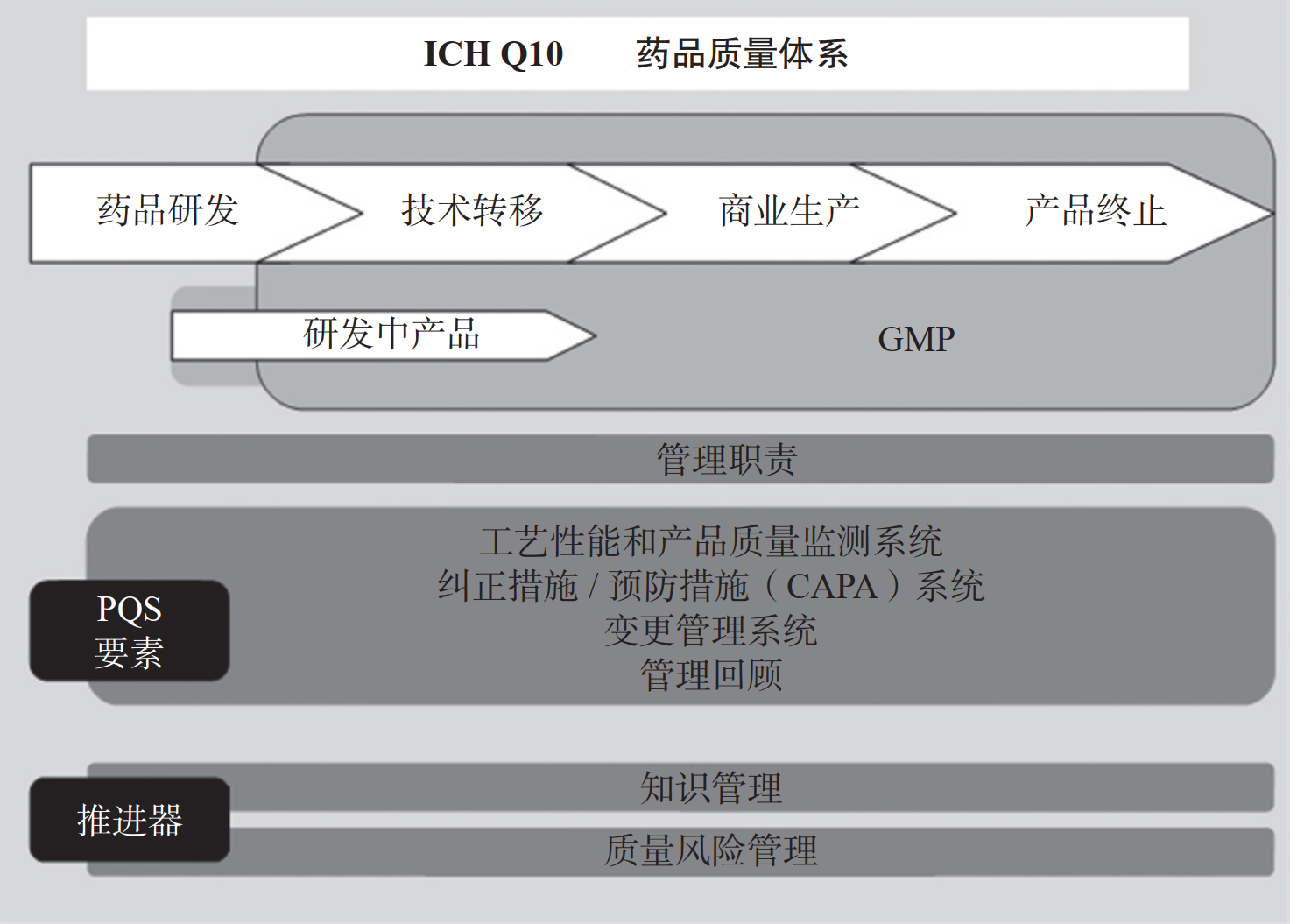
文献学习-MAH 制度下集团型企业一体化质量管理模式的实践与探索-附下载
摘要 在制药行业中,质量是企业生存和发展的基石,它不仅关系到企业的核心价值,更是赢得消费者信任和巩固市场竞争力的关键因素。当下制药企业面临的挑战日益复杂,需要不断创新发展并增强国...
资源分享-202512-美国药典凡例(中英文对照)-允咨
该文件为美国药典(USP-NF)凡例的中英文对照版本,核心围绕药典的适用范围、关键规则及具体要求展开,明确其适用于 USP 和 NF 认可的所有专论与通则,规定了药典的标题版本(含常规修订与加速...
书籍分享-GMP Audits in Pharmaceutical and Biotechnology-2024版
《GMP Audits in Pharmaceutical and Biotechnology Industries》系统、全面地阐述了制药与生物技术行业中良好生产规范(GMP)审计的理论框架、实施方法与实际应用,是一本兼具法规高度与实务深...



















kidzhangy2月前0
感谢分享,楼主好人一生平安Terrific3月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。