![图片[1]-资源分享-202505细胞治疗产品IND申报药学技术一般考虑PPT-陈超等-药研库](https://img.suyu.uk/i/2025/10/24/exub1z.png)
文档结构概述
文档分为四个主要部分,逻辑清晰,从基础概念到实际应用,再到案例和总结:
- 概述(页1-9) 这部分介绍了细胞治疗产品的基本概念、分类和发展现状。
- 定义:细胞治疗产品是通过采集、分离、培养或修饰人体细胞,用于治疗疾病的产品。包括自体细胞、异体细胞等,不同于传统药物,具有活性和异质性。
- 分类:如CAR-T细胞、干细胞、肿瘤浸润淋巴细胞(TIL)等。文档用图表展示了不同类型的机制,例如CAR-T的基因修饰和靶向肿瘤过程。
- 国内批准产品:列出了2021-2025年获批的7款产品,主要针对血液肿瘤,如阿基仑赛注射液(CAR-T靶向CD19)、瑞基奥仑赛注射液等。公司包括传奇生物、药明巨诺等。
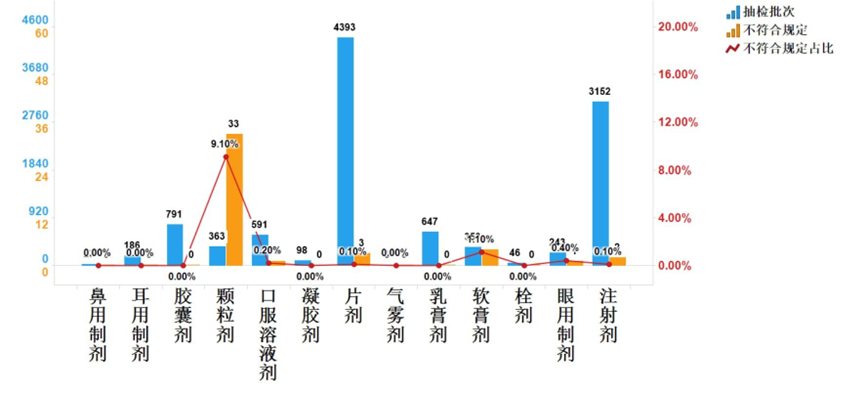
- IND申报统计(2022-2024):共69个品种申报,46%为CAR-T,20%以上为大湾区同期生物制品申报。产品类型以CAR-T为主(39%),适应症多为实体瘤和血液瘤。
- 指导原则和Q&A:引用了CDE和NMPA的多份指南,如2018年的《细胞治疗产品早期临床试验药学研究和申报资料的基本要求》、2023年的《人源干细胞产品药学研究与评价技术指导原则》等。强调安全性、风控和风验评估。
- IND重点:申报需关注产品质量、安全性和风险控制,如产品异质性、污染物控制和风险评估。
- 药学资料要求及技术—般考虑(页10-31) 这是文档的核心,基于CTD(Common Technical Document)格式,详细说明了药学部分的要求。
- 总体框架:采用M4模块,人用药物注册技术要求国际协调会议(ICH)标准。重点在Module 3:质量,包括原料、工艺、控制、稳定性等。
- 模块细分:
- 3.2.S 原药(Drug Substance):包括起始材料(如细胞采集)、生产工艺(如分离、培养、修饰)、质量控制(如纯度、活性、污染物检测)和稳定性。强调GMP合规、病毒安全和风险评估。
- 3.2.P 制剂(Drug Product):产品形式(如注射液)、生产工艺(如配制、冻存)、质量控制(如剂量、纯度)和稳定性。需考虑异质性、污染物(如内毒素)和容器相容性。
- 3.2.A 附录:特殊要求,如CAR-T的载体、转导过程。
- 3.2.R 区域信息:中国特定要求。
- 具体产品考虑:
- 自体/异体细胞:强调供体筛选、安全性(如HIV/HBV检测)和追溯。
- CAR-T:载体(如慢病毒)、转导效率、拷贝数控制、RCR/RCL检测等。需验证工艺变更的 comparability。
- 干细胞:来源(如iPSCs)、诱导分化、肿瘤风险评估。
- 稳定性:冻存液(如DMSO)、运输条件和有效期。
- 关键技术:风险-based approach,过程验证,分析方法开发。强调全生命周期管理,从起始材料到成品。
- 案例分析(页32-36) 通过两个实际案例,剖析常见问题和解决方案。
- 案例一:CAR-T产品 问题:起始材料采集不规范、工艺变更无comparability研究、质量控制项缺失(如拷贝数检测)、稳定性数据不足。 建议:加强供体筛选、验证工艺变更、完善分析方法、提供初步稳定性数据。
- 案例二:干细胞产品 问题:诱导分化效率低、污染物控制弱、适应症支持数据不足。 建议:优化工艺、增强风险评估、补充体外/体内数据。 这些案例强调了申报中药学部分的痛点,如异质性控制和安全性证明,帮助读者避免常见错误。
- 总结(页37-38)
- 强调细胞治疗产品的独特挑战:活性和异质性要求更高的风险控制。
- 建议采用产品特定方法,与监管机构沟通(如CDE会议)。
- 未来趋势:标准化工艺、创新分析方法,推动行业发展。
- 结语:加强基础研究,提升申报质量。
© 版权声明
文章版权归作者所有,未经允许请勿转载。
THE END
喜欢就支持以下吧















kidzhangy4月前0
感谢分享,楼主好人一生平安Terrific5月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。