排序
省局发布《江苏省药品上市后生产场地变更优先受理审评实施细则(试行)》
2024年11月06日,江苏省局发布《江苏省药品上市后生产场地变更优先受理审评实施细则(试行)》(发布之日起实施)。该文件曾在2024年08月05日发布征求意见稿。 文件的目的是加速药品上市后生...
2024年FDA关于数据质量的主要缺陷问题分析(文末附2024年度FDA-483缺陷报告汇总)
在这里,我们将深入探讨2024年FDA检查观察数据集中最常见的违规引用问题,并特别关注数据完整性问题及其长期挑战。基于我们支持生命科学和医疗器械组织的经验,我们还将提供一些关于如何加强202...
值得参考-广东药监发布关于进一步加强药品委托生产监督管理的通知
7月12日,为了进一步加强药品委托生产监督管理,广东省发布了相关事项的通知,对B证持有人及受托生产企业上市后的监督管理工作提出了一些要求。
资源分享-临床前动物安评的管理(法规要求和注意事项)
文件从法规、实操、合作管理三个维度,聊聊临床前动物安评的那些关键要点。 链接:https://pan.quark.cn/s/7661c7f29ec8
ECA-审计追踪审查通用SOP征求意见稿2025-附下载
本文件基于风险评估,提供了一个清晰的框架,帮助制药企业确保患者安全和产品质量。下面,我将解读这份文件的要点,并结合实际应用分享我的见解。 文件概述 指导GMP计算机化系统的审计轨...
一文读懂 EDQM CEP 申请与变更批准全流程-Stepwise process to get a CEP/having a change approved-附下载
对于制药企业而言,获得欧洲药典适用性证书(CEP)是产品进入欧洲及全球多个国家市场的核心门槛之一。欧洲药品质量管理局(EDQM)2025年10月最新发布的《CEP 申请及变更批准分步流程》(PA/PH/C...
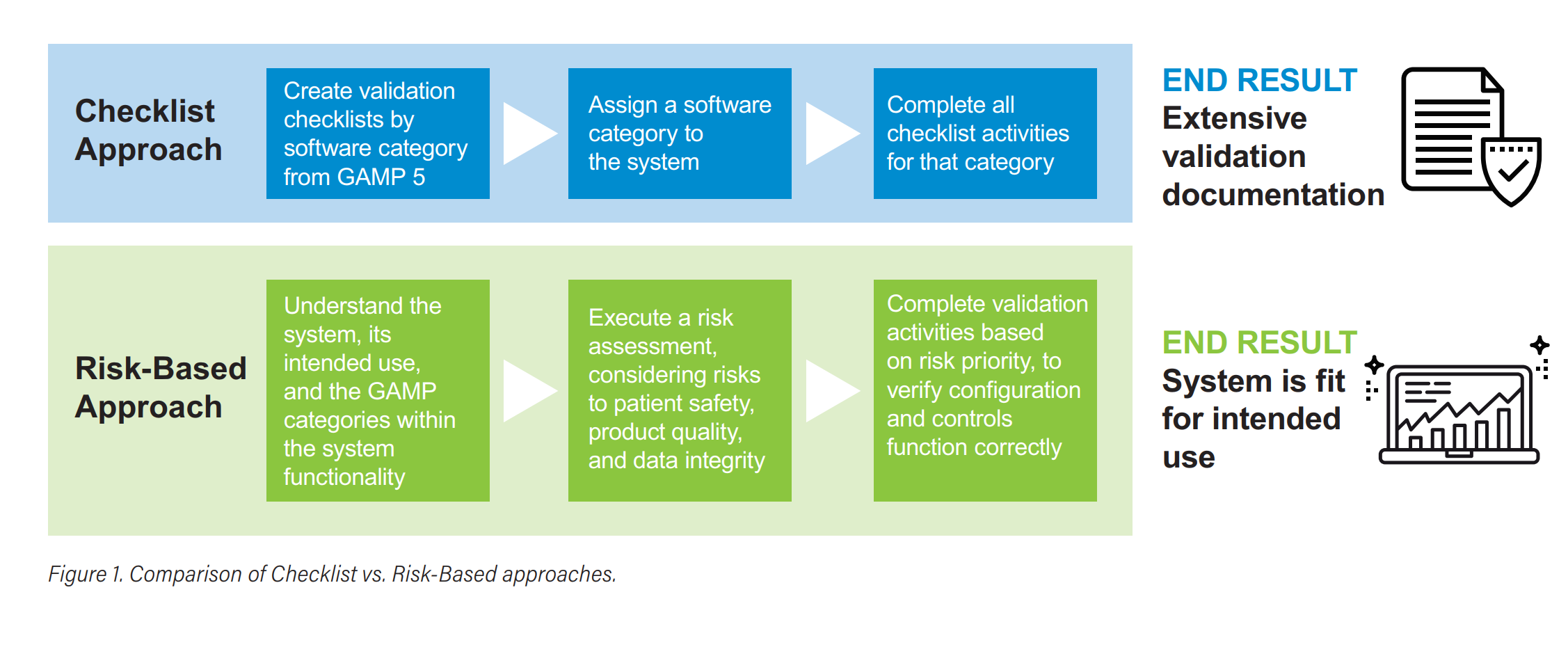
批判性思维,而非简单分类——深度解读Waters 白皮书《Critical Thinking, Not Categorization》-附下载地址
在制药合规圈子里,提到计算机化系统验证(CSV),很多人第一反应就是“这个系统是GAMP几类?我按类别走文档和测试清单就行了”。 但如果你还这么想,真的该好好读读Waters这篇2021年的白皮书了...
资源分享-20251205-江苏药监-江苏药品委托生产现场检查常见缺陷分析(南京分中心)
江苏省药品监督管理局审评核查南京分中心于 2025 年 12 月 5 日举办的药品委托生产现场检查常见缺陷分析培训,系统梳理了药品委托生产过程中在机构与人员、共线生产管理、委托生产管理等多个关...
江苏省局发布药品上市许可持有人药品生产质量安全主体责任清单(2024版)
江苏省局2024年7月份组织的“关于开展企业落实主体责任线上培训”中有提到,省局即将发布的持有人质量安全主体责任正负面清单2024版,替代2023版的清单。 果然08月02日江苏药监发布《关...
资源分享-生物制品质量研究的管理
药品作为特殊商品,其质量直接关系到患者的生命安全与健康。质量研究作为药品研发、生产、流通全链条的核心支撑,是保障药品安全有效的 “生命线”。从质量标准的建立到异常情况的处置,每一个...
















kidzhangy38天前0
感谢分享,楼主好人一生平安Terrific1月前0
感谢!特别有用,资源分享的很及时!北岛1年前0
相当于货架期多久?Mark3年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者4年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。