![图片[1]-资源分享-生物制品工艺研发的管理-药研库](https://img.suyu.uk/i/2025/12/03/e4139b.png)
![图片[2]-资源分享-生物制品工艺研发的管理-药研库](https://img.suyu.uk/i/2025/12/03/e42c3x.png)
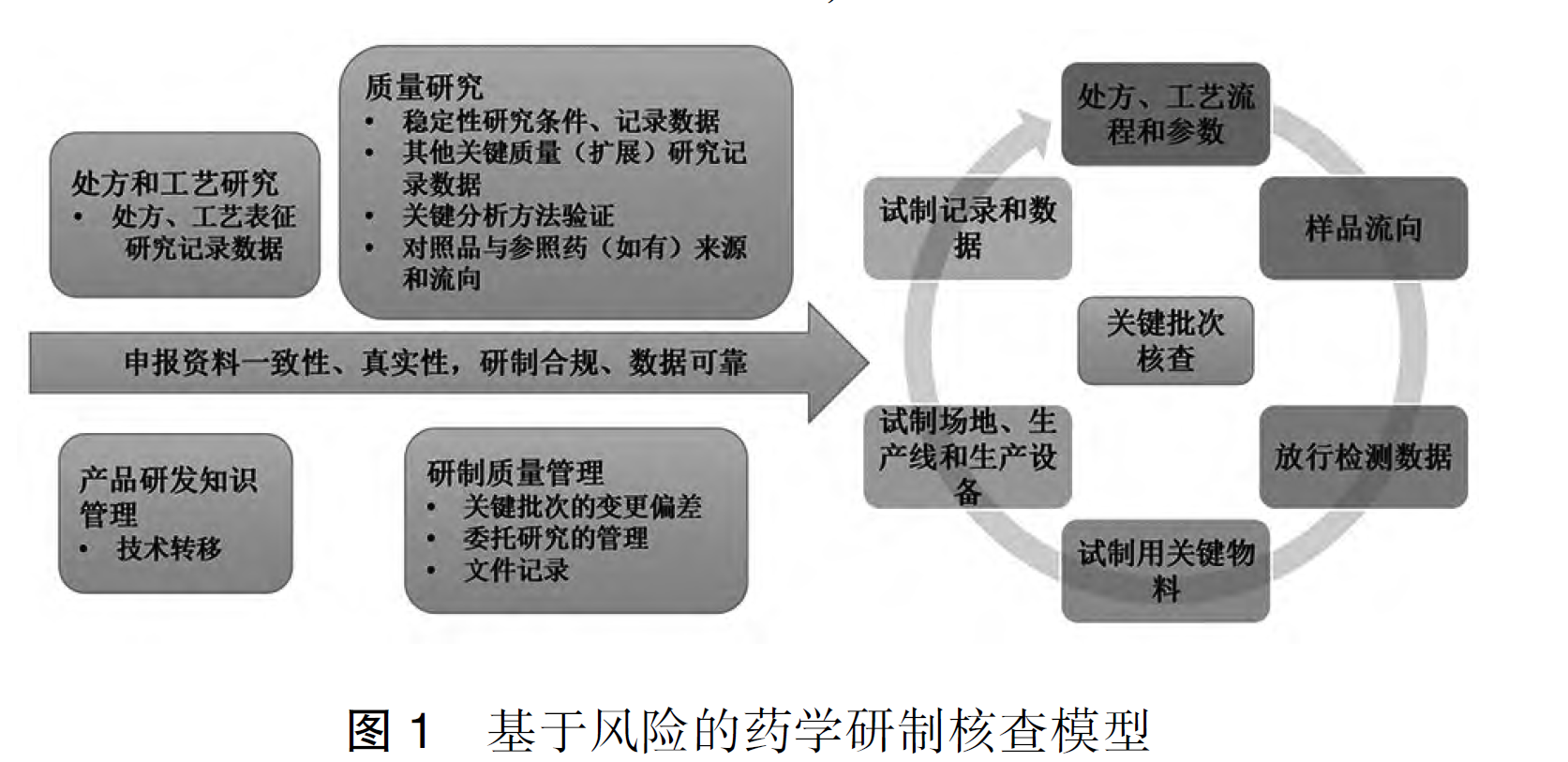
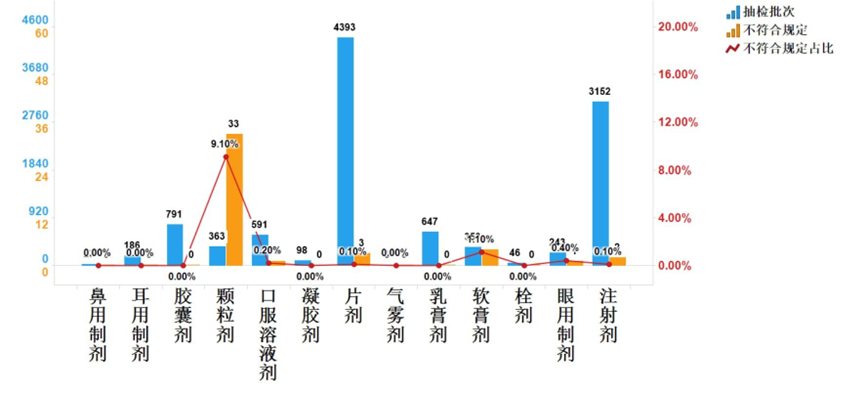
这是一份生物制品(疫苗)工艺研发全流程风险管控干货课件,核心贯穿ICH Q8“质量源于设计(QbD)”理念,强调从小试到商业化全程用风险评估、数据积累、异常闭环来构建稳健工艺,确保工艺可重复、可放大、最终实现“设计一个高质量产品+能持续生产出预期质量产品”的目标。课件分四大模块:1)关键工艺参数(CPP)与质量属性(CQA)风险评估管理,强调临床前每个操作单元全参数监测积累知识,不同阶段CQA/CPP评估目标不同,给出风险=严重性×可能性/不确定性的量化方法及强制性CQA清单;2)物料/设备/文件全要素风险评估,提供关键物料9条评定原则、供应商审计、胰酶活性波动经典案例,设备三层影响性评估(系统-组件-CQA/CPP)及URS-FS/DQ-IQ-OQ-PQ完整验证流程;3)工艺数据管理与总结分析,教你按工序模块积累每批全参数数据,用趋势图、相关性、回收率大数据统计支撑工艺理解;4)异常情况及问题管理,给出真实污染、细胞漂浮、空球等案例台账及FMEA风险优先级评估表。整份课件没有废话,句句血泪,照着落地,你的工艺研发基本不会在后续放大、转移、核查时翻车,是所有工艺负责人、QA、注册同学的案头必备避坑指南。
© 版权声明
文章版权归作者所有,未经允许请勿转载。
THE END
喜欢就支持以下吧
















kidzhangy4月前0
感谢分享,楼主好人一生平安Terrific5月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。