注射用药品因直接进入人体循环系统,其包装密封完整性(Container Closure Integrity, CCI)直接关系到产品无菌性、药效稳定性及患者用药安全。 ECA发布的《注射用药品容器密封完整性测试立场文件》(Version 3.0),这份聚焦 GMP/GDP 法规协调的权威指南,不仅明确了 CCI 测试的核心要求,更提供了可落地的行业最佳实践。
![图片[1]-资源分享-Container Closure Integrity Testing of Medicinal Products for Parenteral Use(ECA发布注射用药品容器密封完整性测试立场文件第三版-202511)-药研库](https://img.suyu.uk/i/2025/11/25/sm9osm.png)
一、文件核心定位与适用范围
这份立场文件并非替代各国药典标准,而是作为补充性指南,旨在统一注射用药品 CCI 测试的行业共识,帮助企业建立科学合规的控制策略。其适用场景覆盖所有注射用药品的包装系统,包括西林瓶、预充式注射器、安瓿瓶、吹灌封(BFS)/ 成型填充密封(FFS)袋等常见形式。
值得关注的是,3.0 版本在原有基础上做了关键更新:新增预充式注射器的 CCI 测试要求,补充了欧盟 Annex 1 法规原文及权威解读,删除了与 CCI 核心无关的微生物环境监测内容,使指南更聚焦核心需求,时效性和针对性大幅提升。
二、关键监管要求拆解:欧盟与美国核心标准
CCI 测试的合规性直接关联产品上市许可,文件重点梳理了欧盟和美国两大市场的核心监管要求,避免企业因法规理解偏差陷入合规风险:
(一)欧盟市场:Annex 1 的刚性要求
欧盟 GMP Annex 1 在 "无菌产品终处理" 章节(8.22-8.25、8.28)明确了 CCI 测试的硬性规范,核心要点可概括为:
- 100% 测试适用场景:熔融密封容器(如玻璃 / 塑料安瓿瓶、BFS/FFS 袋)必须采用验证后的方法进行 100% CCI 测试;100ml 以下小容量熔融密封容器无例外,100ml 以上大容量容器需通过科学数据证明工艺一致性方可减少抽样。
- 非熔融密封容器(西林瓶、注射器):无需强制 100% 测试,但需基于产品认知和风险评估制定抽样计划,可参考 ISO 2859 的 S3/S4 特殊检验水平,常规抽样量为 10-20 个单位(生物制品等特殊情况可酌情调整)。
- 附加控制要求:真空密封容器需在放行前和货架期验证真空维持能力;运输验证需纳入 CCI 测试(考虑减压、极端温度等环境影响);西林瓶压塞前需通过合格的自动化设备检测瓶塞高度,避免因瓶塞移位导致密封失效。
(二)美国市场:USP <1207> 与 FDA 指南
- USP <1207>(非强制性信息章节)将 CCI 测试分为三个核心阶段:产品包装系统开发初期、常规生产过程、货架期稳定性评估,同时提供了不同包装系统的测试方法参考框架。
- FDA 指南明确要求:无菌产品稳定性研究中,CCI 测试需作为补充方法与无菌测试并行,但不可替代初始(T0)和最终(T-final)阶段的无菌测试,核心目的是验证货架期内密封完整性的持续性。
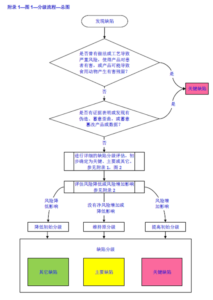
三、生产环节 CCI 控制策略:不止是 "100% 测试"
很多企业误以为 CCI 控制就是 "全检",但文件强调:CCI 是一套贯穿生产全流程的系统工程,100% 测试仅为特定场景的补充措施,核心控制体系需包含以下维度:
1. 仅需 100% CCI 测试的场景
仅针对熔融密封和 FFS 工艺的容器(安瓿瓶、BFS/FFS 袋),其他包装形式无需强制全检,重点通过多环节控制保障完整性。
2. 全流程控制措施(以西林瓶 / 注射器为例)
- 验证阶段(蓝色模块):包括包装材料微生物屏障评估(通过细菌侵入测试 BIT 验证)、无菌工艺模拟(培养基灌装,零污染结果可间接证明密封有效性)、压塞 / 封盖工艺验证(需纳入 CCI 测试确定工艺公差)。
- 批量抽样测试(橙色模块):成品放行时的无菌测试可间接验证 CCI;包装材料需符合尺寸规格要求(如瓶身、瓶塞公差),避免因组件不匹配导致密封缺陷。
- 100% 在线控制(绿色模块):视觉检测(剔除裂纹、划痕、压塞缺陷)、西林瓶瓶塞高度检测(行业标准:高度差 < 1mm 视为微生物密封合格,需通过验证确认)。
- 供应商管理(紫色模块):定期监控初级包装材料供应商的工艺变更,评估其对 CCI 的潜在影响,避免因组件质量波动引发密封风险。
3. 特殊情况的灵活调整
若风险评估显示现有控制措施无法充分保障 CCI,可建立针对 "最大允许泄漏率(MALR)" 的 100% 测试方法,但需注意:测试方法的灵敏度需匹配实际风险,避免过度检测导致不必要的成本增加;若采用破坏性测试,抽样计划需符合统计合理性(如 ISO 2859-1 的 S3/S4 水平),不建议仅测试单个样品。
四、货架期稳定性评估中的 CCI 测试要点
货架期内的 CCI 验证是保障产品全生命周期质量的关键,文件明确以下核心要求:
- 测试需与无菌测试并行开展,样本需能代表批量生产的实际情况(建议使用真实生产中的缺陷样品,如裂纹瓶,而非人工制造的非代表性缺陷)。
- 测试方法的缺陷检测能力需不低于微生物侵入测试,可通过实验验证或参考行业公认标准设定阈值。
- 稳定性研究的 CCI 结果仅作为控制策略的验证依据,不可用于成品放行决策 —— 放行仍需依赖生产过程中的多环节控制数据。


















kidzhangy3月前0
感谢分享,楼主好人一生平安Terrific4月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。