排序
药品类易制毒化学品的购用证明申请
目前药品类易制毒化学品相关法规中,最重要的就是2010年3月18日发布《药品类易制毒化学品管理办法》(原卫生部令第72号),对于其购用申请按照一般该管理办法中附件6进行。 博主由于公司项目...
欧盟监管部门关于基因与细胞治疗产品的相关法规和指导原则汇总-20220325update
2001.11.06 Directive 2001/83/EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to medicinal products for human use2005.03 Guideline...
省局发布《江苏省药品上市后生产场地变更优先受理审评实施细则(试行)》
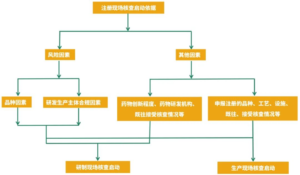
2024年11月06日,江苏省局发布《江苏省药品上市后生产场地变更优先受理审评实施细则(试行)》(发布之日起实施)。该文件曾在2024年08月05日发布征求意见稿。 文件的目的是加速药品上市后生...
解读欧盟GMP附录22征求意见稿:人工智能在药品制造中的应用-附文件下载(双语)
近期,人工智能(AI)正式“入编”欧盟GMP指南! 欧盟引入了全新附录22,为药品及活性物质制造过程中AI的应用设定了明确监管标准。该附录主要关注通过机器学习(ML)实现功能的模型在关键GMP流...
药品上市许可持有人制度的思考- B证的尽头是A证?
1 B证的尽头是A证? 去年10月23日NMPA发布的132号文,对持有人的监管提高了一个新的高度。10月24日药监综药管〔2023〕81号出台的文件其实对各省药监部门监管也提出了很多要求,以强化对持有...
FDA指导原则合集(FDA Guidance Documents)-持续更新
本文持续更新FDA的指导原则并打包,方便离线检索查阅,内容覆盖从FDA发布的从1975至今的所有指导原则,截至2025年7月22日,FDA共发布2275个指南文件。
江苏省局发布《推动企业落实质量安全主体责任的激励和约束措施管理规定》(试行)(征求意见稿)解读
2024年02月23日江苏省局《推动企业落实质量安全主体责任的激励和约束措施管理规定》(试行)(征求意见稿),具体内容大家可以在官网查看,我们主要来分析下这个文件的影响。 此次规定明确了...
资源分享-ECA 注射用药品目视检查 V5.0-中英双语
在制药行业,注射用药品的目视检查是保障产品质量与患者安全的关键环节 —— 作为无菌产品放行前的 “最后一道视觉防线”,它直接关系到药品是否存在颗粒污染、容器缺陷等风险。近日,ECA 基金...
MAH最新监管方向-文献《我国药品上市许可持有人(MAH)制度实施路径问卷调研与结果分析》的思考
今天我们来看一篇发表于《中国食品药品监管杂志》的文献,文献主要内容是由沈阳药科大学亦弘商学院组织开展“我国药品上市许可持有人制度实施路径研究”课题研究。通过对我国MAH 制度落地实施过...
202512-计量校准管理办法(征求意见稿)
全文下载地址:https://pan.quark.cn/s/3dbd4c3306ac 起草说明 一、制定的必要性 计量校准起源于工业生产领域,是现代计量中为保障计量器具量值准确可靠而普遍采用的一种技术手段...

















kidzhangy2月前0
感谢分享,楼主好人一生平安Terrific3月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。