![图片[1]-资源分享-从注册核查看临床试验质量管理-广州新药申报服务中心20250926-药研库](https://img.suyu.uk/i/2025/11/24/i9f15m.png)
作为药品上市前的关键监管环节,临床试验质量管理直接关系到受试者权益保护与药品安全有效性评价。近期学习了广州市黄埔区新药申报服务中心李璇老师的《从注册核查看临床试验质量管理》专题分享,系统梳理了注册核查的核心逻辑、关键维度与质量优化路径,今天整理成实用指南分享给行业同仁,助力临床试验全流程合规落地。
一、注册核查核心认知:定义、沿革与依据
1. 什么是注册核查?
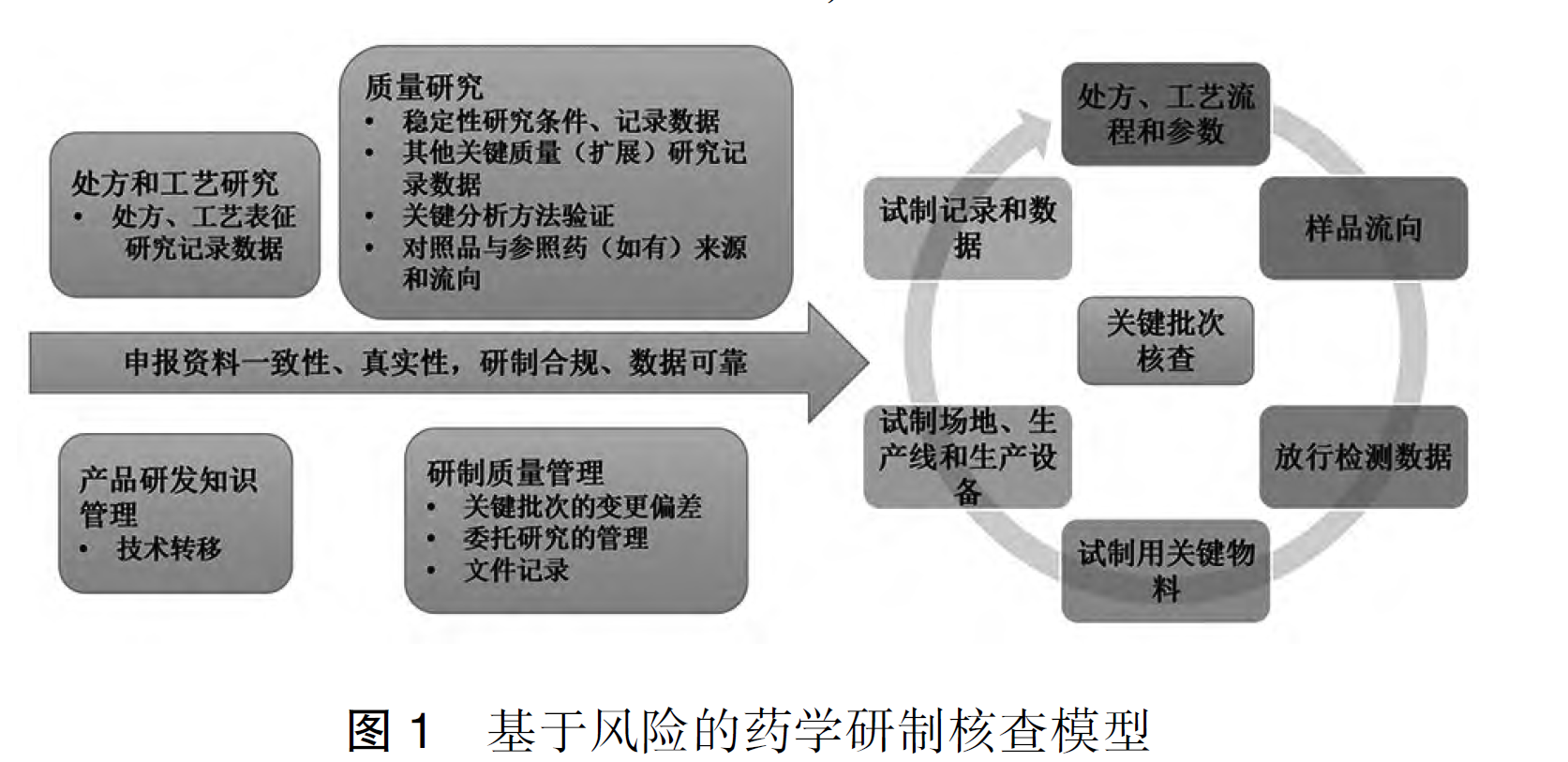
注册核查是药品监管部门为核实申报资料真实性、一致性,确认药品研制合规性与数据可靠性,对研制现场(含药学、药理毒理学、临床试验)和生产现场开展的核查活动。其中,药物临床试验现场核查是确保试验过程规范、结果科学可靠的核心手段,也是药品技术审评的源头基础 —— 毕竟申报资料的有效性,离不开原始记录与源数据的支撑。
2. 核查制度的历史演进
我国临床试验核查制度逐步走向精细化、风险化,关键时间节点值得关注:
- 2005 年:《药品注册管理办法》首次确立 “实地确证” 和 “原始资料审查” 的基本核查方式;
- 2007 年:明确省局受理后 5 日内组织现场核查的要求,形成 “逢审必查” 模式;
- 2020 年:新版《药品注册管理办法》与 GCP 同步实施,正式确立 “基于风险启动核查” 的核心模式;
- 2022 年:《药品注册核查要点与判定原则(药物临床试验)》落地,核查标准更具体、判定更清晰。
如今,创新药、改良型新药、生物制品的上市申请均需接受上市前核查,多中心临床试验重点关注机构合规性,仿制药 BE 试验则按风险等级随机抽查,核查覆盖面与精准度显著提升。
3. 核查核心依据
整个核查工作围绕两大核心文件展开:
- 《药物临床试验质量管理规范(GCP)》:从 1998 年试行到 2020 年正式版,持续优化受试者保护与数据管理要求;
- 专项核查文件:如《药物临床试验数据现场核查要点》《药品注册核查要点与判定原则》,明确核查具体内容与判定标准。
二、核查的底层逻辑:3 大目标 + 2 大原则
1. 三大核心目标(不可偏离的底线)
- 受试者权益与安全保护:这是 GCP 的最高原则,贯穿临床试验全流程;
- 数据真实性与一致性:原始数据需符合 ALCOA + 标准(可归因、易读、同时性、原始、准确),且与申报资料完全一致;
- 试验合规性确证:全过程需遵循 GCP、相关法规、试验方案及 SOP。
2. 两大基本逻辑(核查工作的核心思路)
- 基于风险:聚焦对受试者安全和数据质量影响最大的关键环节,不搞 “一刀切”;
- 基于证据:所有结论必须以客观记录、原始数据等实证为依据,拒绝主观判断。
三、现场核查关键维度:7 大模块 + 合规要点
现场核查围绕 7 大核心维度展开,每个维度都有明确的核查重点与常见风险点,直接关系核查结果:
1. 临床试验许可与条件(基础合规性)
- 合规文件:需具备机构备案证明、临床试验批件 / 通知书、伦理批件、研究合同等完整文件;
- 软件要求:人员需具备相应资质与授权,培训到位;文件体系需覆盖全流程并及时更新;
- 硬件要求:仪器设备需校准合格、维护到位,急救设施有效运转;实验室需通过室间质评,具备独立空间(如知情同意场所、中心药房)。
常见风险:人员授权不合理、培训不足;急救设施欠缺;文件未及时更新。
2. 伦理审查(受试者权益核心)
核查重点包括伦理委员会组成是否合规、审查流程是否符合 SOP、安全性信息处理是否规范、受试者损害是否得到及时补偿等。
常见风险:未建立安全性信息处理 SOP;审查记录与伦理批件不一致;受试者补偿未兑现。
3. 临床试验实施过程(核心执行环节)
这是核查的重中之重,涵盖 5 个关键节点:
- 知情同意:签署时间不得早于伦理批准,筛选时间不得早于知情同意签署,特殊群体需本人参与签署;
- 受试者筛选入组:需严格符合入排标准,随机化与盲态保持需合规,偏离方案需记录并解释;
- 安全性信息处理:AE/SAE 需完整记录、及时报告,相关性判断需有明确依据,严禁瞒报漏报;
- 数据记录与报告:源数据需载入病历,修改留痕,病例报告表与源数据、数据库、申报资料一致;
- 数据溯源:病例报告表信息需可追溯至 HIS、LIS、PACS 等系统,合并用药、检验数据等需有实证支撑。
4. 试验用药品管理(全程可追溯)
需满足 “来源可查、去向可追、数量相符”:
- 具备来源证明、检验报告、GMP 生产证明;
- 接收、贮存、分发、使用、回收、销毁全环节记录完整;
- 运输储存条件符合方案要求,批号与相关资料一致。
5. 生物样品管理
样品接收、处理、检测、储存、销毁记录完整,检测方法需验证,结果可溯源。
6. 中心实验室及独立评估机构
实验室需通过室间质评,具备完整质量管理体系;独立评估机构人员资质合规,评估流程与记录符合 SOP,结果可溯源。
7. 临床试验数据采集与管理
- 纸质记录需受控管理,修改留痕;
- 电子数据采集系统需验证,具备权限管理与稽查轨迹功能;
- 数据转换需一致可见,数据库锁定流程合规。
四、核查启示:质量管理的 4 大核心思想
通过注册核查的要求,我们能清晰把握临床试验质量管理的核心逻辑:
- 质量源于设计:试验质量的根基在设计阶段,需兼顾科学性与可操作性,比事后补救更重要;
- 过程导向:核查不仅关注结果,更重视 “怎么做”,过程合规是结果可靠的前提;
- 完整证据链:“没有记录 = 没有发生”,所有行为需留痕,形成清晰可追溯的证据链;
- CAPA 文化:通过纠正预防措施(CAPA)持续改进,结合根本原因分析,实现质量体系闭环。
五、质量体系优化:多主体实操建议
临床试验质量管理不是单一主体的责任,申办方、研究团队、临床试验机构、SMO 需协同发力:
1. 申办方(核心责任主体)
- 坚持 “质量源于设计”,聚焦 6 大质量关键点(方案设计、研究可行性、受试者安全性等);
- 推行基于风险的监查(RBM),结合 PDCA 循环与 CAPA,及早排查风险;
- 建立独立的质量保证系统,通过稽查发现体系问题,减少系统误差。
2. 研究团队与临床试验机构
- 完善 SOP 体系与应急预案,做到 “有章可循、有据可依”;
- 加强人员资质管控与培训,优化质控方向,重点关注受试者安全与疗效指标评判;
- 利用信息化系统实现数据互通与管理增效,规范病历记录。
3. SMO
- 保障 CRC 资质与稳定性,规范人员进出机制;
- 严格遵守院方与研究团队管理要求,严禁越权操作。















kidzhangy3月前0
感谢分享,楼主好人一生平安Terrific4月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。