排序
资源分享-浙江省药品检查中心《药品生产企业药用辅料和包材常见缺陷分析》(2025.09.19)-附下载
在当前的药品生产监管环境下,“物料系统”(特别是辅料和包材)正成为飞行检查和注册核查的重灾区。很多企业往往重原料药、轻辅料包材,导致在合规性上频频“踩雷”。朱老师关于《药品生产企业...
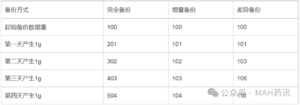
装量与规格-江苏省局上市后变更问答的思考
昨天,本公众号发了省局的上市后变更问答(链接:江苏药监-上市后变更专栏近期新增问答汇总)中第三个问题是这样的。 省局贴心地表示该答复来自CDE官网。 确实在CDE通过关键字“增加...
202504-Empower收到FDA 483警告信
据FDA于2025年4月2日向Empower Clinic Services LLC dba Empower Pharma发布的警告信(编号700962),以下是该警告信的主要内容分析: 1. 生产环境控制与无菌操作缺陷 微生物污...
资源分享-202509大湾区分中心-药品注册核查(药学研制和生产现场)常见问题分析及预防策略
一、常见问题分析 结合分中心 2021-2025 年核查数据,梳理出研制和生产现场最易踩雷的问题,每个问题都配案例、讲风险、给方案~ (一)药学研制现场:9 大问题占比最高 1. 质量管理:...
省局答复-纯A证药品生产企业是否可以直接将批文转给另外一家A证企业?
近期收集到朋友向省局老师咨询的答复,与大家分享下。朋友的问题是:“纯A证药品生产企业是否可以直接将批文转给另外一家A证企业?”(注:受让方有相应剂型的生产许可范围) 省局答复如下:...
江苏药监局发布《药品生产企业质量安全主体责任指导手册(2.0版)》-附下载地址
为深入贯彻落实《中华人民共和国药品管理法》和全国药品监管工作会议精神,推动药品生产企业全链条压实质量安全主体责任,江苏省药监局于近日正式印发《药品生产企业质量安全主体责任指导...
202506-PDA-Contamination control strategy (CCS) in Pharma and Biopharma Manufacturing制药和生物制药制造中的污染控制策略-附下载
在制药和生物制药行业,药品质量直接关系到患者生命安全。而污染问题,作为影响药品质量的关键风险点,往往会引发产品召回、生产停滞甚至监管处罚等一系列严重后果。污染控制策略(CCS)作为一...
工作站的常见几种数据备份的差异
早先写过关于变色龙网络工作站的数据备份,详见Thermo网络工作站(变色龙chromeleon)数据备份。我们知道为了保障数据完整性,制药行业的关键电子数据往往需要进行数据备份,原数据应该在产品生...
QC实验室详细审计表(GMP和GLP)分享
引言 在制药、生物技术和医疗器械行业,实验室的质量管理是确保产品安全和合规性的核心。GMP(良好生产规范)和GLP(良好实验室规范)作为国际标准,指导着生产和实验过程的质量控制。为了帮...
202505-PDA-Sterility Assurance – Meeting an Industry Unmet Technical Need on Design and Operation of Restricted Access Barrier Systems (RABS)制药行业RABS设计与操作:满足未满足的无菌保障技术需求-附下载
一、RABS 的行业定位:介于隔离器与传统工艺之间的优化选择 与隔离器相比,RABS 虽因无法实现完全密闭的自动化生物去污流程,产品污染风险相对略高,但相比传统的帷幕式工作台无菌工艺,其防...


















kidzhangy2月前0
感谢分享,楼主好人一生平安Terrific3月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。