排序
资源分享-202509大湾区培训-口服固体制剂工艺验证的研发考量
在口服固体制剂的研发与商业化进程中,工艺验证是保障产品质量一致性、合规性的核心环节。尤其对于缓释、控释等复杂制剂,工艺参数的细微波动可能直接影响产品的关键质量属性(CQA),进而影响...
资源分享-PDA70 Fundamentals of Cleaning and Disinfection Programs for Aseptic Manufacturing Facilities 无菌生产设施的清洁消毒程序原理-双语版本
PDA 第 70 号技术报告《无菌生产设施的清洁消毒程序原理》作为行业权威指南,系统梳理了清洁消毒的核心逻辑、执行标准与实操要点。 链接:https://pan.quark.cn/s/a2ce7ddb070b
2025年第六期“药审云课堂”-课件和培训视频分享
6月6日,CDE进行了2025年度第六期药审云培训,本期以“药品注册申报常见问题”为主题,系统展示药品注册申报流程及多层级多渠道沟通交流机制,让公众更好地了解药品审评工作,同时帮助申请人科...
资源分享-山东药监-药品GMP检查手册(上,下)
本书是专为药品GMP检查员、监管人员和药企从业者设计的便携式工具书。它于2021年2月发布,旨在配合新药品管理法的实施,推动药品生产质量管理水平的提升。 上册(法规篇):基础法律法规...
资源分享IND注册申报要求及注意事项
在创新药研发的漫长征程中,IND(Investigational New Drug,新药临床研究审批)申报是连接临床前研究与临床试验的关键桥梁。它不仅是对药物安全性和临床方案合理性的官方检验,更是药企合规研...
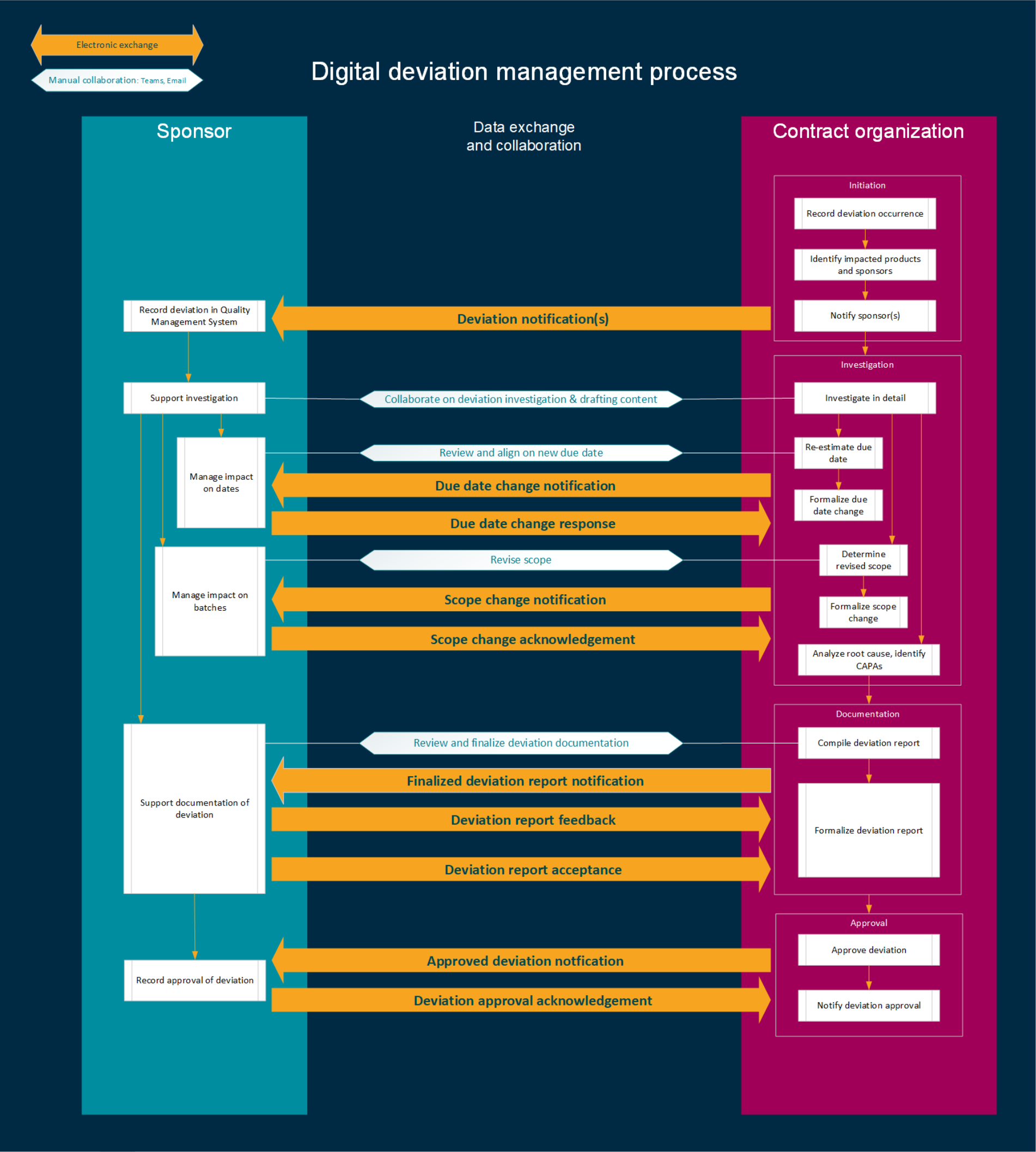
委托生产的数字化偏差管理协同(Digital deviations: Improving sponsor— CMO collaboration-附biophorum双语原文)
摘要 在生物制药行业内管理偏差是确保产品质量、法规合规性以及最终患者安全的关键流程。如今,委托方与合同制造组织(CMOs)之间的偏差管理过程高度依赖人工操作,复杂且分散,导致效率低...
21 CFR Part 312 Investigational New Drug Application (IND)-新药临床试验申请 中英文双语对照
《21 CFR Part 312》是美国食品药品监督管理局(FDA)制定的关于新药临床试验申请 (IND)的管理法规,规定了药物在正式上市前开展临床研究的全过程监管要求。该法规最初于 1987 年发布,...
EMA PMS FAQ:欧洲药品管理局的产品管理服务常见问题解答202511(Product Management Service (PMS) – Frequently Asked Questions (FAQs))-附下载地址
《Product Management Service (PMS) – Frequently Asked Questions (FAQs)》,发布于2025年11月21日。它汇集了PMS相关活动中通过Slido.com收集的常见问题,并按主题分类解答。作为医药监管领...
FDA 2025医疗器械提交电子副本(eCopy)计划行业与 FDA 工作人员指南(eCopy Program for Medical Device Submissions Guidance for Industry and Food and Drug Administration Staff)-附下载
2025 年 12月 3日,美国食品药品监督管理局(FDA)正式发布了更新后的《医疗器械提交电子副本(eCopy)计划行业与 FDA 工作人员指南》。该指南取代了 2020 年 4 月 27 日的旧版内容,进一步明确...
ECA-审计追踪审查通用SOP征求意见稿2025-附下载
本文件基于风险评估,提供了一个清晰的框架,帮助制药企业确保患者安全和产品质量。下面,我将解读这份文件的要点,并结合实际应用分享我的见解。 文件概述 指导GMP计算机化系统的审计轨...



















kidzhangy34天前0
感谢分享,楼主好人一生平安Terrific1月前0
感谢!特别有用,资源分享的很及时!北岛1年前0
相当于货架期多久?Mark3年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者4年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。