排序
资源分享-202512-CDE-放射性新药要学审评中常见问题和考虑-周浩晖
该文件是药审中心化药药学一部 2025 年 12 月发布的关于放射性新药药学审评的专业指引,明确了放射性药品(用于临床诊断或治疗的放射性核素制剂或其标记药物)的发展现状(传统企业与新入局企业...
资源分享-20251014CFDI药品注册现场核查准备-韩雨
在药品研发注册的赛道上,现场核查是关乎产品能否成功获批的关键环节。它不仅是对企业研发数据、生产合规性的全面检验,更是对企业质量管理体系的 “大考”。本文件结合国家药监局核查中心的官...
资源分享-浙江省药品检查中心《药品生产企业药用辅料和包材常见缺陷分析》(2025.09.19)-附下载
在当前的药品生产监管环境下,“物料系统”(特别是辅料和包材)正成为飞行检查和注册核查的重灾区。很多企业往往重原料药、轻辅料包材,导致在合规性上频频“踩雷”。朱老师关于《药品生产企业...
一文读懂 EDQM CEP 申请与变更批准全流程-Stepwise process to get a CEP/having a change approved-附下载
对于制药企业而言,获得欧洲药典适用性证书(CEP)是产品进入欧洲及全球多个国家市场的核心门槛之一。欧洲药品质量管理局(EDQM)2025年10月最新发布的《CEP 申请及变更批准分步流程》(PA/PH/C...
解读 FDA 实验室数据完整性 (DI) 审查指南:不仅仅是 ALCOA-Data Quality and Integrity Investigation in Laboratories (Analytical)-附资料下载
在制药行业的质量体系中,“数据完整性”(Data Integrity, DI)早已不是一个新概念,但它依然是 FDA 检查官在现场检查(Inspection)中挖掘“宝藏”的重灾区。 今天为大家分享一份来自 FDA ...
202510奥星-全球法规趋统背景下的产品共线生产与清洁验证-附下载
该 文件围绕全球法规趋同背景下的药品共线生产与清洁验证展开,系统介绍了共线生产的概念及国内外相关法规要求,聚焦产品全生命周期(研发、技术转移、生产、上市后)的清洁验证管理,详解了清...
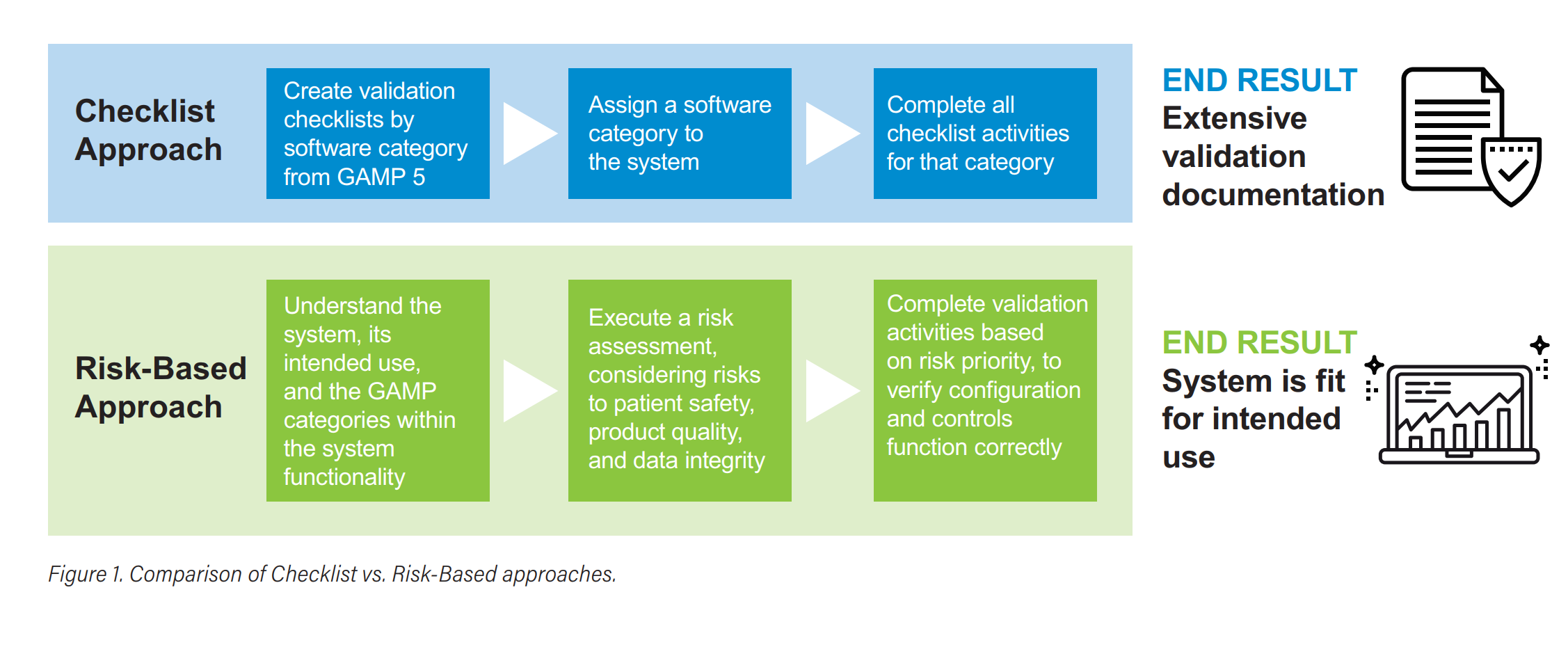
批判性思维,而非简单分类——深度解读Waters 白皮书《Critical Thinking, Not Categorization》-附下载地址
在制药合规圈子里,提到计算机化系统验证(CSV),很多人第一反应就是“这个系统是GAMP几类?我按类别走文档和测试清单就行了”。 但如果你还这么想,真的该好好读读Waters这篇2021年的白皮书了...
202511-PDA-从极端污染控制失败中吸取教训Contamination Control Failures-What we learn from worst case scenarios-附下载
在生物制药行业,无菌生产是不可逾越的红线,而污染控制则是守护这条红线的核心防线。然而,即使是流程规范的药企,也可能因看似微小的疏忽陷入污染危机。近日,Parenteral Drug Association(P...
资源分享-DB1310T 369—2025化学分析实验室玻璃仪器使用规范
2025年6月30日,廊坊市市场监督管理局正式发布了DB1310/T 369—2025《化学分析实验室玻璃仪器使用规范》,并于7月30日起实施。这份地方标准由廊坊市药品检验所、廊坊市人民医院、廊坊市产品质量...
资源分享-202509大湾区分中心-药品注册核查(药学研制和生产现场)常见问题分析及预防策略
一、常见问题分析 结合分中心 2021-2025 年核查数据,梳理出研制和生产现场最易踩雷的问题,每个问题都配案例、讲风险、给方案~ (一)药学研制现场:9 大问题占比最高 1. 质量管理:...




















kidzhangy41天前0
感谢分享,楼主好人一生平安Terrific1月前0
感谢!特别有用,资源分享的很及时!北岛1年前0
相当于货架期多久?Mark3年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者4年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。