排序
20251211-上海药监-上海市药品主动召回实施指南(征求意见稿)》发布-附下载
背景 药品召回是保障公众用药安全的关键环节。根据国家《药品召回管理办法》和相关规定,药品上市许可持有人(简称“持有人”)必须主动监测风险,并在发现质量问题或安全隐患时及时召回。这...
202512-EMA-Guideline on the Development and Manufacture ofSynthetic Peptides-合成肽的开发与生产指南-附下载
该文件是欧洲药品管理局(EMA)于 2025 年 12 月发布的《合成肽的开发与生产指南》(2026 年 6 月生效),旨在规范合成肽类药物的开发、生产、表征、质量控制等关键环节,补充现有相关指南未覆...
202507-EMA-Review of AI/ML applications in medicines lifecycle (2024)药品生命周期内人工智能和机器学习的应用-附下载
当 AlphaFold 精准预测蛋白质结构加速药物靶点发现,当数字孪生技术缩减临床试验周期,当 AI 算法实时监测上市药物的安全信号 —— 人工智能(AI)与机器学习(ML)正以颠覆性力量,渗透药物从...
202512海南药监发布《海南省药品生产检查缺陷整改技术指南(试行)》-附下载
近期,海南省发布《药品生产检查缺陷整改技术指南(试行)》(以下简称《指南》),为被检查单位提供了系统性的整改框架和实操指引。 一、适用范围 作为法规落地的技术支撑文件,《指南》...
20251203-CDE重磅发布!《化学仿制药药学研究重大缺陷(试行)》征求意见稿解析-附下载
2025年12月3日,CDE发布通知,公开征求《化学仿制药药学研究重大缺陷(试行)(征求意见稿)》等文件的意见 。这份文件不仅仅是一个技术清单,更是一次审评逻辑的重大调整。核心内容在于:对于...
20251209-黑龙江药监问答汇总(药品审评-疫苗-经营-生产检查相关)
药品审评问答 1.《已上市化学药品药学变更研究技术指导原则(试行)》规定,某些中等变更需提供1~3批检验报告,请问具体应该提供几批? 答:指导原则中检验报告批次的设定范围(1~3批)...
202512FDA指南-Promotional Labeling and Advertising Considerations for Prescription Biological Reference Products, Biosimilar Products, and Interchangeable Biosimilar Products Questions and Answers 生物类似药促销宣传的合规指南问答-附下载
2025 年 12 月,美国食品药品监督管理局(FDA)发布了《处方药生物参考产品、生物类似药和可互换生物类似药的促销标签和广告考量问答指南》,为制药企业的合规宣传提供了明确指引。在生物类似药...
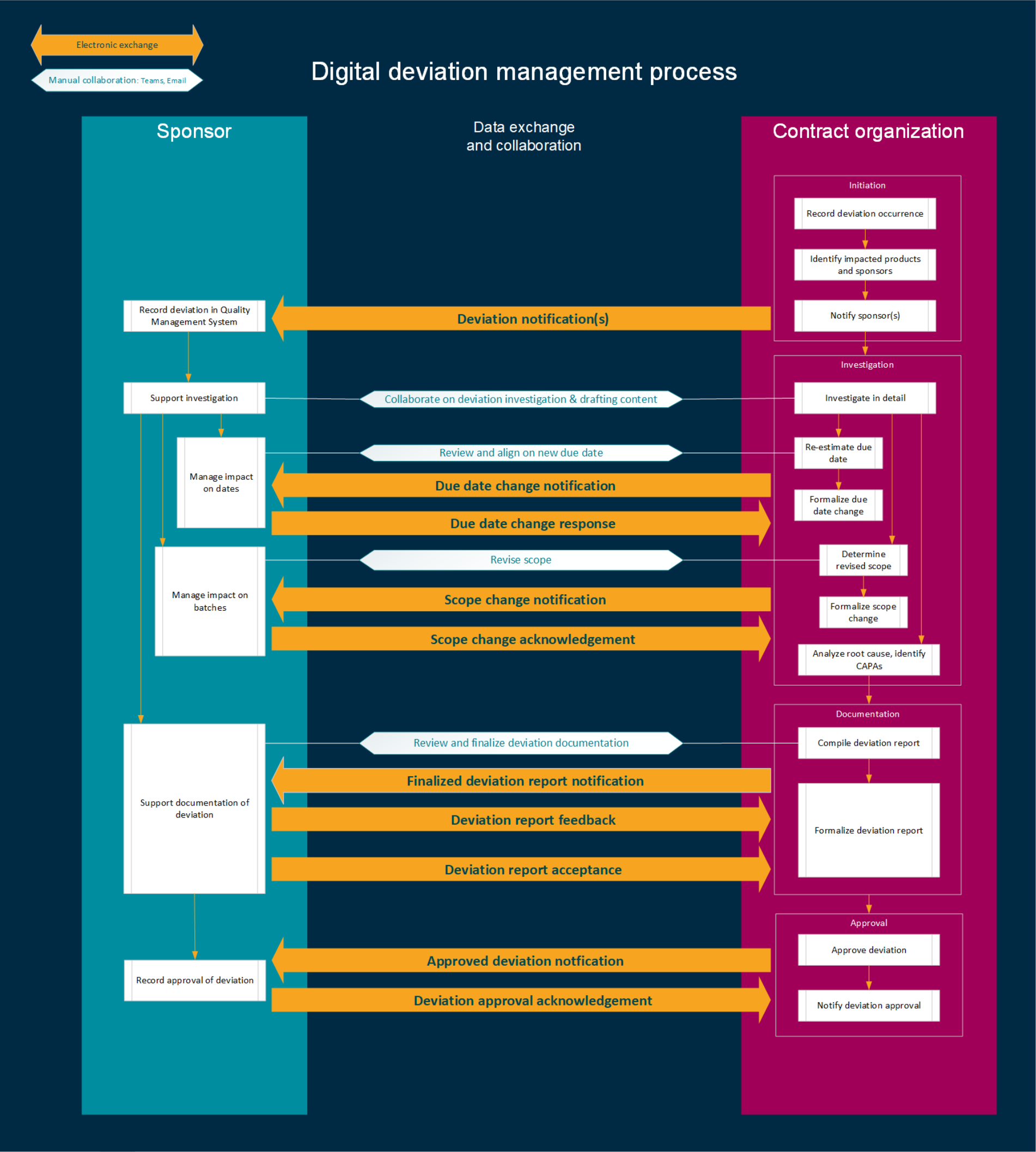
委托生产的数字化偏差管理协同(Digital deviations: Improving sponsor— CMO collaboration-附biophorum双语原文)
摘要 在生物制药行业内管理偏差是确保产品质量、法规合规性以及最终患者安全的关键流程。如今,委托方与合同制造组织(CMOs)之间的偏差管理过程高度依赖人工操作,复杂且分散,导致效率低...
文献学习-MAH 制度下集团型企业一体化质量管理模式的实践与探索-附下载
摘要 在制药行业中,质量是企业生存和发展的基石,它不仅关系到企业的核心价值,更是赢得消费者信任和巩固市场竞争力的关键因素。当下制药企业面临的挑战日益复杂,需要不断创新发展并增强国...
20251203-EMA Classification of changes: questions and answers-EMA变更分类新规解析-附下载
欧盟药品管理局(EMA)的变更分类规则直接关系到产品上市后变更的合规推进。2025 年 11 月,EMA 更新了《变更分类问答手册》,针对行政变更、质量变更、(非)临床变更及编辑性变更四大核心场景...














kidzhangy2月前0
感谢分享,楼主好人一生平安Terrific3月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。