排序
资源分享-20251014CFDI药品注册现场核查准备-韩雨
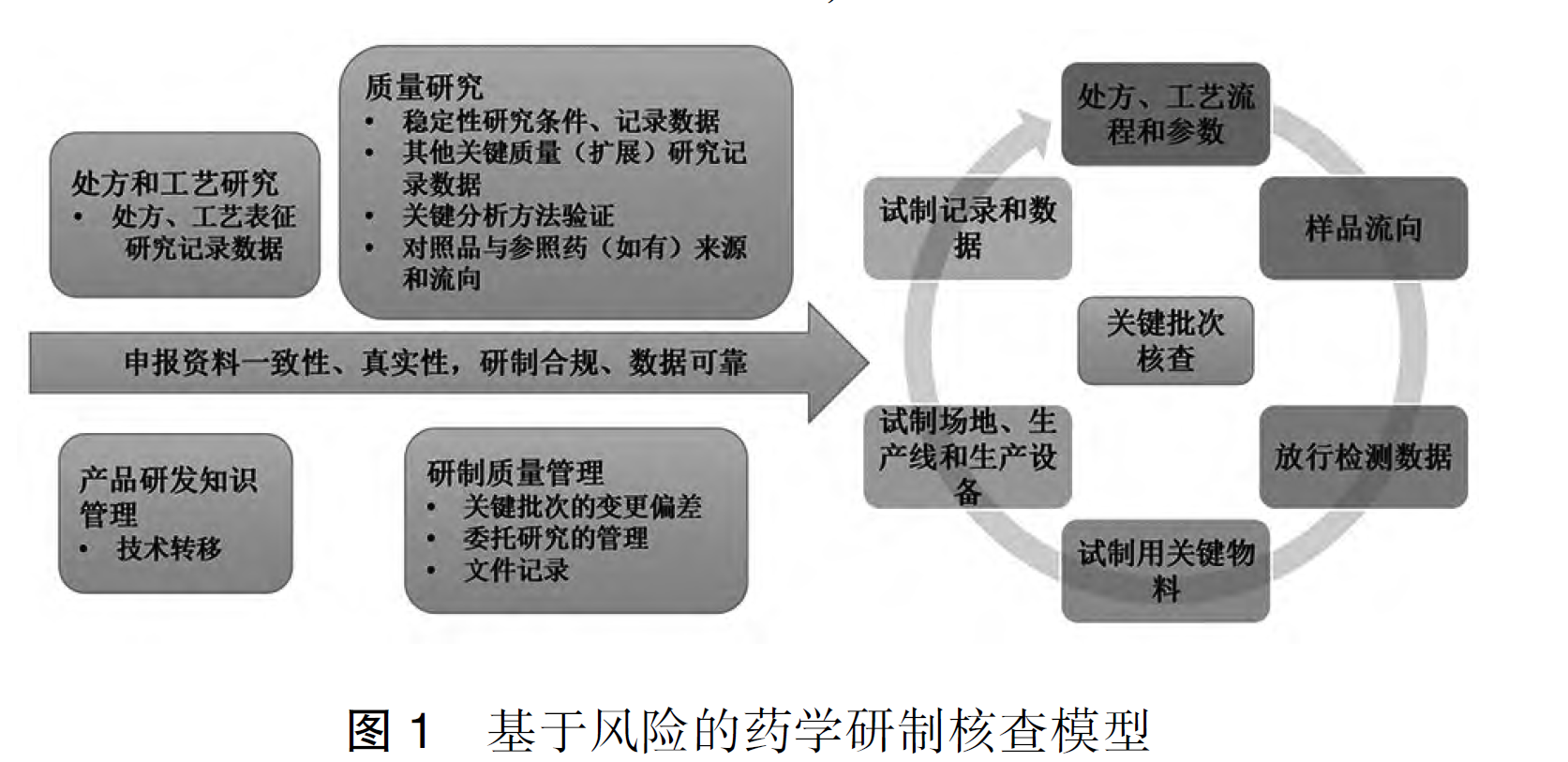
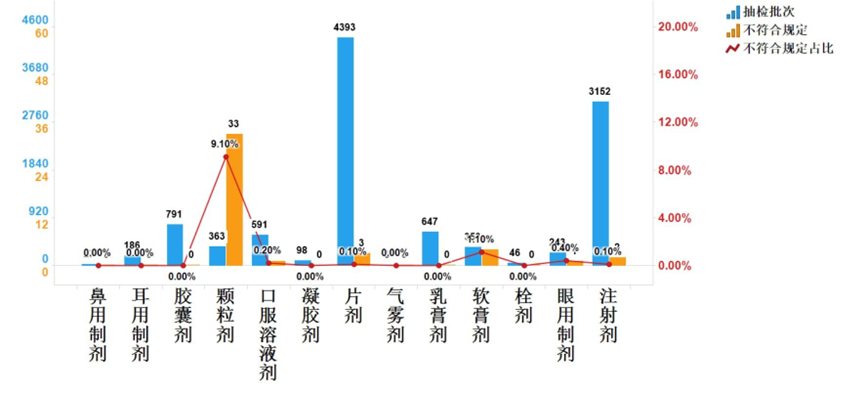
在药品研发注册的赛道上,现场核查是关乎产品能否成功获批的关键环节。它不仅是对企业研发数据、生产合规性的全面检验,更是对企业质量管理体系的 “大考”。本文件结合国家药监局核查中心的官...
2019-奥星-Compilation of Global Data Integrity Regulations & Guidance全球数据可靠性法规指南汇编(第 6 版)-附下载
数据可靠性指南汇编,方便大家学习,文件截至2019年10月,部分文件不是最新 链接:https://pan.quark.cn/s/9e9d376ecebb
202512-WHO-Human genomics technologies in clinical studies – the research landscape(1990-2024)人类基因组技术临床研究报告分析 (1990-2024)-附下载
报告概述 世界卫生组织 (WHO) 最新发布的《人类基因组技术在临床研究中的应用 —— 研究全景》报告,对 1990-2024 年间全球基因组技术临床研究进行了全面分析。该报告基于 WHO 国际临床试...
2025病原微生物实验室生物安全管理-附下载地址
课件严格对标《中华人民共和国生物安全法》(2021)、《病原微生物实验室生物安全管理条例》(424号令)、WS233-2017《病原微生物实验室生物安全通用准则》、GB19489-2008《实验室生物安全通用...
资源分享-药典凡例-印度药典(2022)
《印度药典 2022 年版(IP 2022)凡例》为药典标准、试验、测定及正文表述等提供基本指导原则,明确了法定药品(含法定物质、制剂)的定义与适用范围(含人用和兽药,除非明确限定),规定药品...
资源分享-2019-中检院-食品检验操作规范(微生物检验)
《食品检验操作技术规范(微生物检验)》作为《中国食品药品检验检测技术系列丛书》的一员,核心内容围绕食品微生物检验展开,共分为六个部分。总论部分涵盖微生物检验的质量控制、方法确认与验...
资源分享-中检院-生物制品检验技术操作规范2019版
本书为《中国食品药品检验检测技术系列丛书》之一,其内容主要包括通用检测方法和各类生物制品的特异性检测方法。通用检测方法,只收录了至少两大类制品共同使用的方法,有些方法虽然在某一大类...
202502-FDA-人工智能和机器学习在药品和生物制品研发过程中的运用Using Artificial Intelligence & Machine Learning in the Development of Drug & Biological Products-附下载
当人工智能(AI)与机器学习(ML)技术渗透到医疗健康的核心领域,药物开发这一长期被 “高投入、长周期、高风险” 困扰的行业,正迎来前所未有的变革契机。近日,美国食品药品监督管理局(FDA...
资源分享-202510-NMPA上市后安全性分析及研究的统计学考量-廖珊妹
培训围绕《药物警戒质量管理规范》,系统阐述药品上市后安全性分析及研究的统计学相关内容,涵盖数据来源(欧盟、美国、中国等监管机构数据库、WHO 的 VigiBase 及商业数据库)、数据分析方法(...
解读 WHO 2026 版医药产品技术新规:供应商合规与质量保障指南Technical Requirements for Medicines and Health products In ITBs/RFQs-附下载
2026 年 1 月,世界卫生组织(WHO)发布了《招标 / 询价中药品和健康产品技术要求》(第 5 版),旨在通过更严格、更细致的技术规范,保障全球范围内 WHO 采购产品的质量、安全性和可及性。这份...



















kidzhangy4月前0
感谢分享,楼主好人一生平安Terrific5月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。