排序
Public feedback to FDA on regulatory considerations for AI in drug manufacturing(FDA关于AI在药物制造中的监管考虑)-附下载
2025年5月,一篇名为《Public feedback to FDA on regulatory considerations for AI in drug manufacturing》的论文在AAPS Open期刊上发表,由FDA的专家团队撰写。这篇论文总结了公众对FDA 202...
转载-谈谈计算器的验证(Dennis Wang-王军)
说到计算器的要做验证,可能有人会比较急。先请你不要急,凡是在行业突然提出这个问题,肯定会有他的道理。首先看看计算器用来干什么,如果说计算器就是用来算算1+1是不是等于2这种低级的整数计...
资源分享-上海合成生物与生物制造产业发展白皮书(2025)
《上海合成生物与生物制造产业发展白皮书(2025)》由上海市合成生物产业协会与沙利文联合发布,系统阐述了合成生物学作为第三次生命科学革命和新质生产力的核心价值,梳理了其与生物制造 “从 ...
202512-MHRA-Good Clinical practice for clinical trails(2025版 MHRA GCP 指南)-附下载
作为临床试验领域的核心监管标准,良好临床规范(GCP)是保障受试者权益、确保试验数据真实可靠的基石。英国药品和健康产品管理局(MHRA)于 2025 年 12 月更新的《临床试验良好临床规范指南》...
书籍推荐-《The ASQ Certified Quality Engineer Handbook》(ASQ 认证质量工程师手册)第五版
本书是《The ASQ Certified Quality Engineer Handbook》(ASQ 认证质量工程师手册)的第五版,由 Scott A. Laman 编辑,出版于 2022 年,由 ASQExcellence 发行。全书总页数超过 576 页(从目...
资源分享-202512-药品注册审评缺陷研究-by zhulikou431(丁恩峰老师)
这份由丁香园 zhulikou431 (丁老师)编写的《药品注册审评缺陷研究》(R139修订本)是一部深度汇总了2010年至2025年跨度的药品注册案例集,旨在通过分析CDE(药审中心)在审评审批中提出的缺陷...
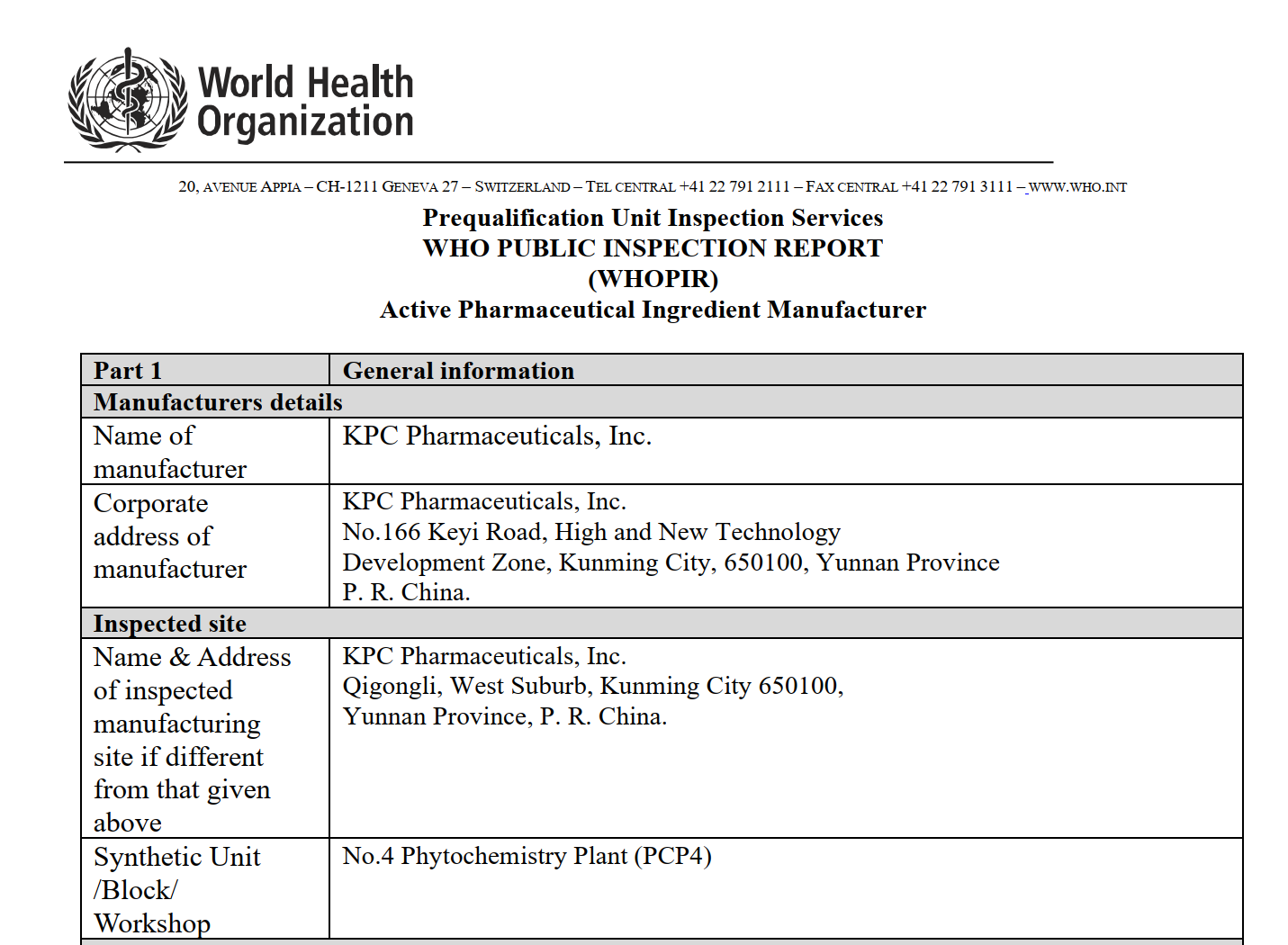
从昆明制药WHO检查报告看API企业的国际化合规道路-附下载
近期,世界卫生组织(WHO)发布了针对昆明制药集团股份有限公司(KPC Pharmaceuticals, Inc.)的公开检查报告(WHOPIR)。此次审计于2025年6月9日至13日进行,旨在对其生产的原料药(API)蒿甲...
20251206-CDE第十二期药审云答疑问题汇总
问题1:2.6生产工艺的开发部分,是否应该将小试阶段做过的所有(均体现),还是说仅汇总关键工艺参数相关的即可? 解答1:工艺开发部分对于原料药申报资料很重要。对于仿制药来说,首先应基...
资源分享-20251205-江苏药监-江苏药品委托生产现场检查常见缺陷分析(南京分中心)
江苏省药品监督管理局审评核查南京分中心于 2025 年 12 月 5 日举办的药品委托生产现场检查常见缺陷分析培训,系统梳理了药品委托生产过程中在机构与人员、共线生产管理、委托生产管理等多个关...
2019-奥星-Compilation of Global Data Integrity Regulations & Guidance全球数据可靠性法规指南汇编(第 6 版)-附下载
数据可靠性指南汇编,方便大家学习,文件截至2019年10月,部分文件不是最新 链接:https://pan.quark.cn/s/9e9d376ecebb




















kidzhangy2月前0
感谢分享,楼主好人一生平安Terrific3月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。