排序
资源分享-2025年医药行业年终总结-政策篇(易联招采网)
这份 文件是《2025 年医药行业年终总结政策篇》(236张幻灯片),主要内容是对 2025 年医药行业政策环境的全面总结和分析。 PPT 涵盖了医药行业的多个重要政策领域:从医药卫生体制改革、药...
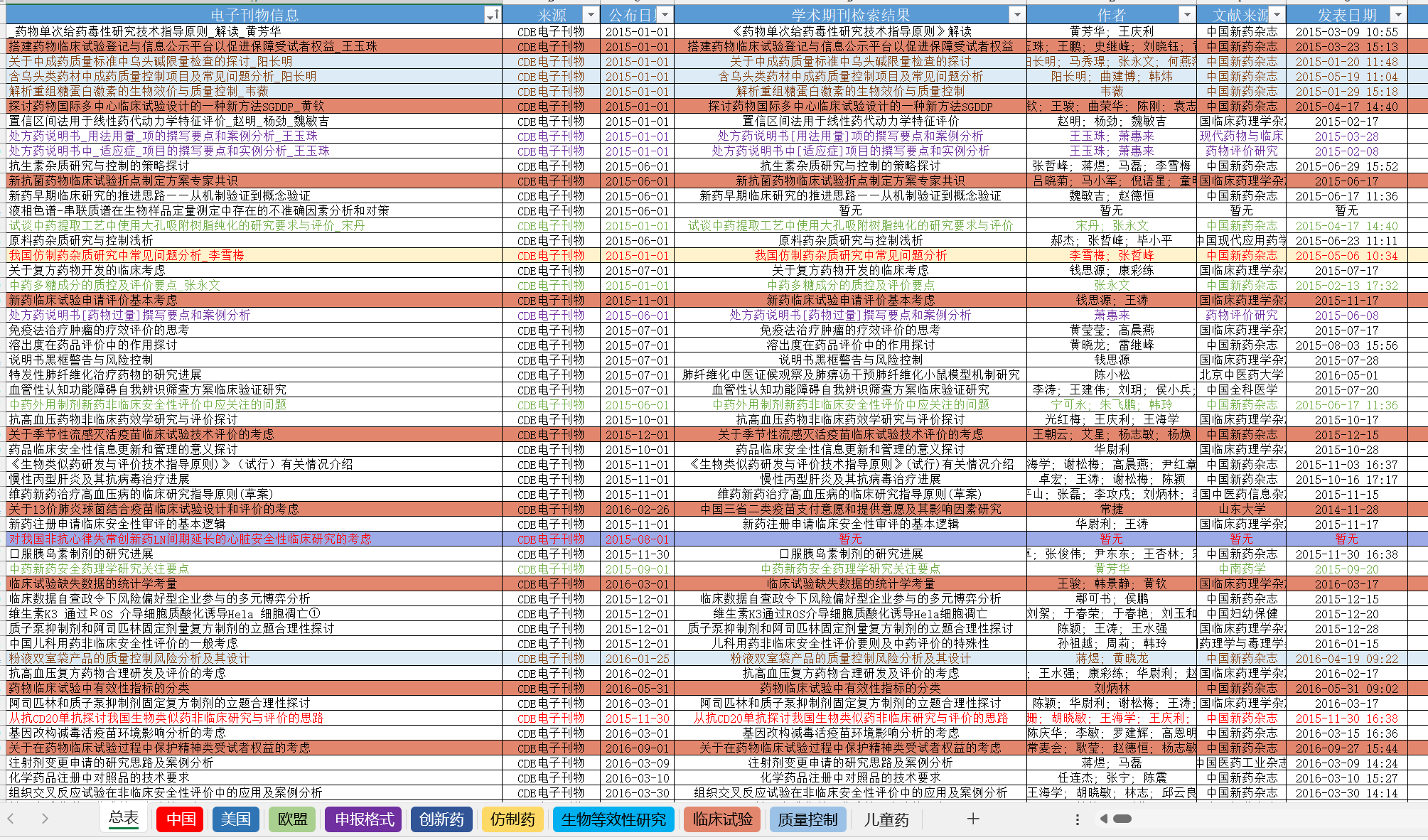
资源分享-CDE电子刊物总览
引言 在药品研发、审评和监管领域,及时获取专业、全面的信息至关重要。今天要给大家分享一份资源 ——CDE 电子刊物总览(2015-至今),这是一个涵盖丰富药品领域知识的信息宝库。 内...
资源分享-中检院-生物制品检验技术操作规范2019版
本书为《中国食品药品检验检测技术系列丛书》之一,其内容主要包括通用检测方法和各类生物制品的特异性检测方法。通用检测方法,只收录了至少两大类制品共同使用的方法,有些方法虽然在某一大类...
202512-计量校准管理办法(征求意见稿)
全文下载地址:https://pan.quark.cn/s/3dbd4c3306ac 起草说明 一、制定的必要性 计量校准起源于工业生产领域,是现代计量中为保障计量器具量值准确可靠而普遍采用的一种技术手段...
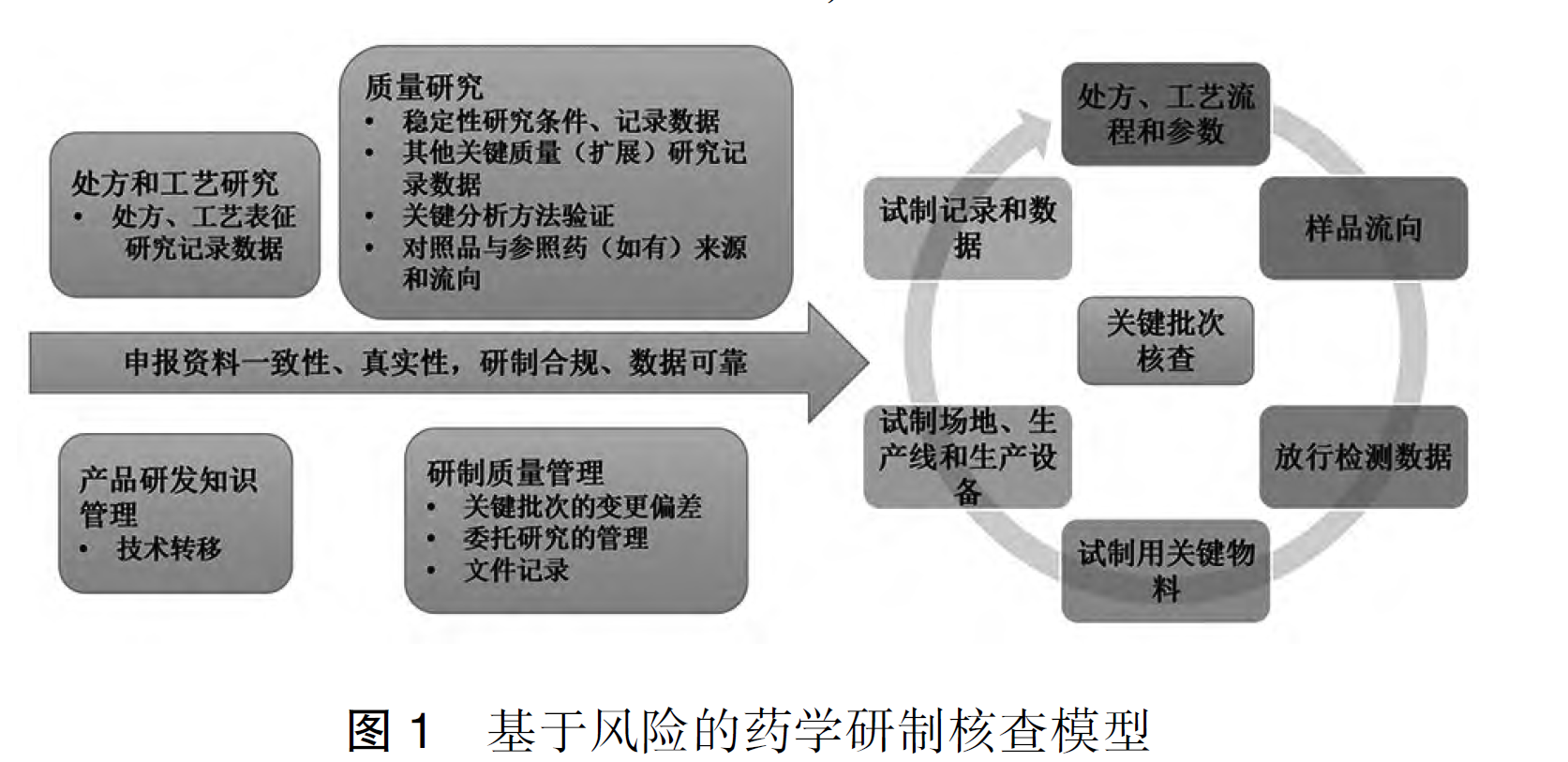
重磅文献分享-生物制品药学研制核查要点和常见问题分析(2025 CFDI 张平)-附下载
摘要 生物制品的生产和质量控制过程中,存在诸多可变性和特殊性。在新的药品注册监管法规体系下,研制现场核查是促进生物制品研发相关数据真实可追溯,推动生物制品研发行业规范和高质量发展...
202509-EMA-Guidelines on the details of the various categories of variation欧盟药品上市许可变更新指南(2026生效)-附下载
2026 年 1 月 15 日,欧盟《药品上市许可变更分类及流程指南》(C/2025/5045)将正式生效,替代沿用 13 年的 2013 版指南。这份经 2024 年修订的新规,通过简化流程、优化分类、强化工作共享机...
资源分享-202512-美国药典凡例(中英文对照)-允咨
该文件为美国药典(USP-NF)凡例的中英文对照版本,核心围绕药典的适用范围、关键规则及具体要求展开,明确其适用于 USP 和 NF 认可的所有专论与通则,规定了药典的标题版本(含常规修订与加速...
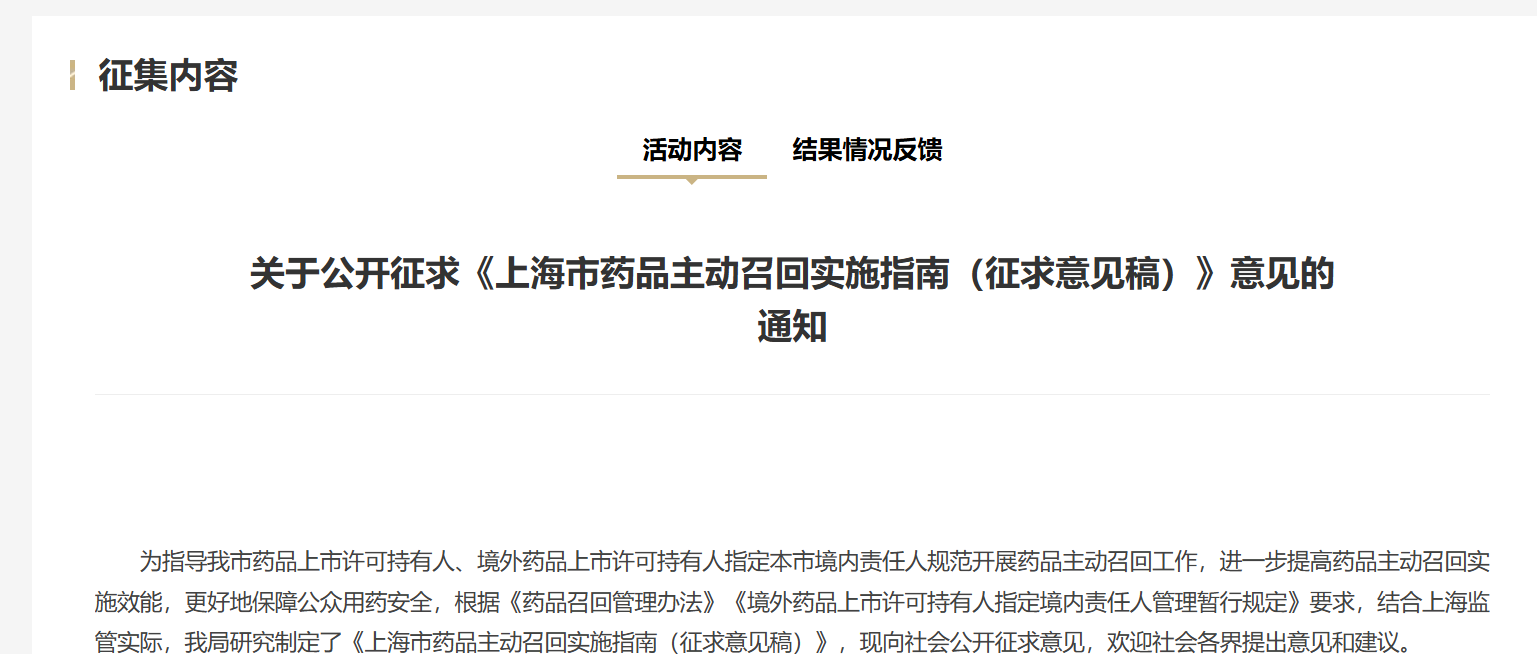
20251211-上海药监-上海市药品主动召回实施指南(征求意见稿)》发布-附下载
背景 药品召回是保障公众用药安全的关键环节。根据国家《药品召回管理办法》和相关规定,药品上市许可持有人(简称“持有人”)必须主动监测风险,并在发现质量问题或安全隐患时及时召回。这...
书籍分享-GMP计算机化系统实施与检查指南(2025版张金贵)
《GMP 计算机化系统实施与检查指南》由张金贵所著,聚焦药品生产领域计算机化系统的 GMP 合规管理,系统涵盖计算机化系统的定义、分类、GMP 基本要求与管理框架,详细阐述系统开发与验证、运行...
转载-2025年CDE官方问答全梳理(截至20260109)
2025年,国家药品监督管理局药品审评中心(CDE)持续围绕药品注册申报中的关键环节、高频疑问与共性难题,发布了一系列具有指导意义的共性问题解答。为帮助业界更清晰把握政策导向、提升申报效...















kidzhangy4月前0
感谢分享,楼主好人一生平安Terrific5月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。