排序
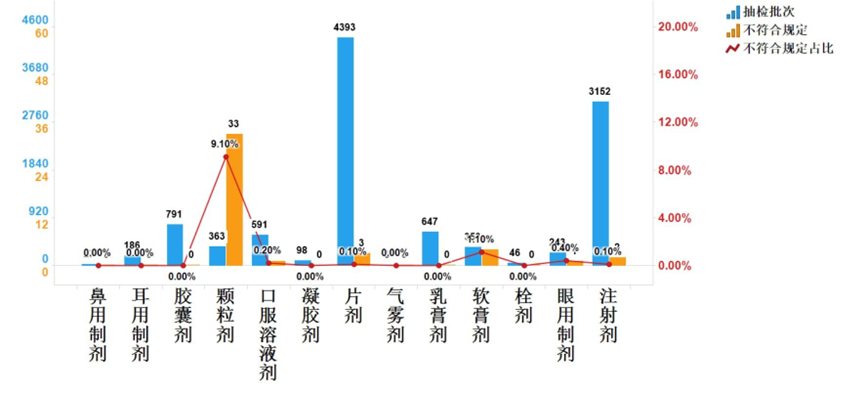
资源分享-中国仿制药行业发展报告(2025年)
引言 仿制药作为医药工业的重要组成部分,对于降低药品费用、保障药品供应、推动医药产业发展起着至关重要的作用。2025 年《中国仿制药发展报告》的发布,为我们深入了解行业现状、把握发...
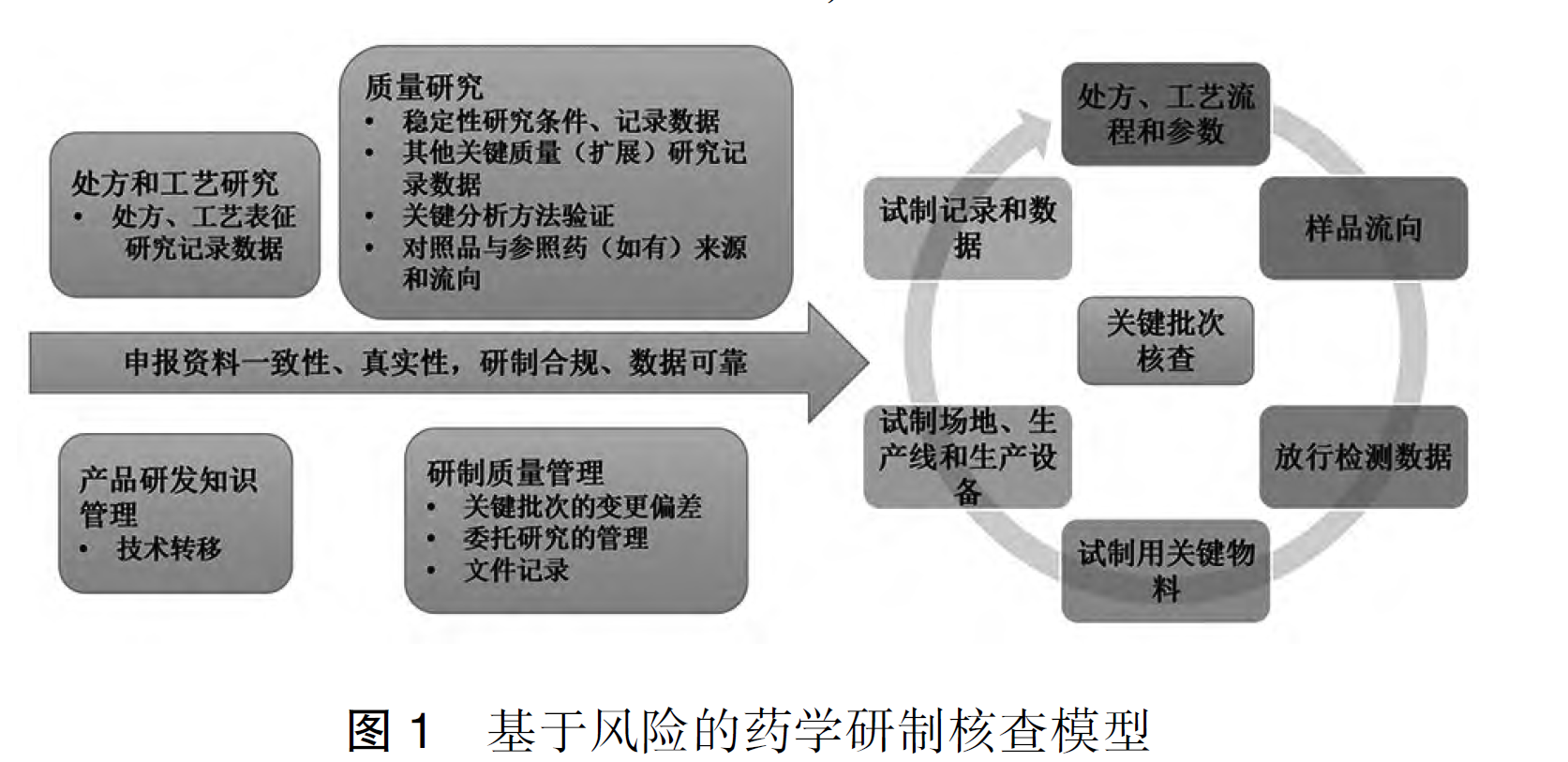
202510-MHRA-Decentralised Manufacturing-overview and considerations去中心化制造概况和考虑-附下载
2025 年 10 月,在夏洛特举办的 ISPE 年会上,英国药品和医疗保健产品监管局(MHRA)重磅解读了全新的分散制造(Decentralised Manufacturing, DM)监管框架。这一框架的落地不仅是制药行业监管...
药品与医疗器械警戒监管全球洞察-科睿唯安2025《保持领先地位 —药品和医疗器械警戒领域的前瞻性监管情报 》-附下载
在医疗健康行业飞速发展的今天,药品与医疗器械的安全性始终是公众关注的核心,而警戒监管作为保障产品全生命周期安全的关键环节,正随着技术革新与全球医疗格局变化不断升级。科睿唯安近期发布...
202406-官方培训-药品共线生产与清洁验证专题培训班培训讲义(宁波)
该文件是国家药品监督管理局高级研修学院 2024 年 6 月宁波专题培训班的培训讲义,核心围绕《药品共线生产质量风险管理指南》展开,系统涵盖指南起草背景、核心原则(法律法规优先、持有人主责...
资源分享-生物制品质量研究的管理
药品作为特殊商品,其质量直接关系到患者的生命安全与健康。质量研究作为药品研发、生产、流通全链条的核心支撑,是保障药品安全有效的 “生命线”。从质量标准的建立到异常情况的处置,每一个...
书籍推荐-《The ASQ Certified Quality Engineer Handbook》(ASQ 认证质量工程师手册)第五版
本书是《The ASQ Certified Quality Engineer Handbook》(ASQ 认证质量工程师手册)的第五版,由 Scott A. Laman 编辑,出版于 2022 年,由 ASQExcellence 发行。全书总页数超过 576 页(从目...
202511-真实世界研究RWS赋能药品进院合规增量新路径
文件围绕真实世界研究(RWS)展开,阐述其已从药品补充证据升级为医药企业增长关键引擎,详解了其在药品上市早期点亮灯塔用户、市场拓展期挖掘超说明书价值、竞争白热化期打造差异化优势、生命...
FDA指导原则合集(FDA Guidance Documents)-持续更新
本文持续更新FDA的指导原则并打包,方便离线检索查阅,内容覆盖从FDA发布的从1975至今的所有指导原则,截至2025年7月22日,FDA共发布2275个指南文件。
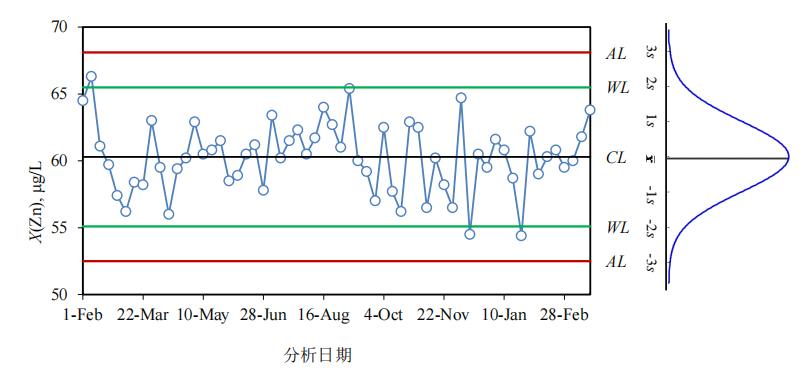
转载:警戒限与行动限制定原则与方法-附下载
一、法规、文件引用 (1) 实施指南《无菌药品》分册 14.3.1a) 限度确立方法:i. 可以根据历史数据,结合不同洁净区域的标准制订。如采用数理统计 (正态分布法) 的方法,一般可以将平均值加上 2...
资源分享-202501消毒剂相关培训
文件为消毒剂相关培训资料,核心围绕消毒剂作用原理与效果确认两大模块展开。在作用原理部分,明确了消毒、灭菌、无菌等关键定义,按氧化类、酚类、醛类、醇类等类别详解其杀菌机理、特点及适用...


















kidzhangy4月前0
感谢分享,楼主好人一生平安Terrific5月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。