排序
202510-ISEP-BMS‘s journey to a tech-enabled global transformationBMS 的技术驱动全球转型之旅-附下载
2025 年 10 月 26-29 日,国际制药工程协会(ISPE)年度会议暨博览会将在北卡罗来纳州夏洛特市线下启幕,并同步开启线上直播。这场汇聚全球生命科学领域精英的行业盛会中,10 月 27 日上午 10:4...
资源分享-202512-工业和信息化部-制造业中试标准体系建设指南(2025版)
《制造业中试标准体系建设指南(2025 版)》由工业和信息化部牵头出台,为解决制造业中试环节无标可依、成果转化堵点等问题,以 “系统布局、急用先行等” 为原则,明确到 2027 年累计制修订标...
资源分享-202512-Concept Paper on the revision of Annex 3 of the guidelines on Good Manufacturing Practice for Radiopharmaceuticals《放射性药品良好生产规范(GMP)附录 3 修订概念文件》
该文件是欧洲药品管理局(EMA)与药品检查合作计划(PIC/S)联合发布的《放射性药品良好生产规范(GMP)附录 3 修订概念文件》,拟修订 2008 年版《放射性药品生产》附录 3,替代现有 Eudralex ...
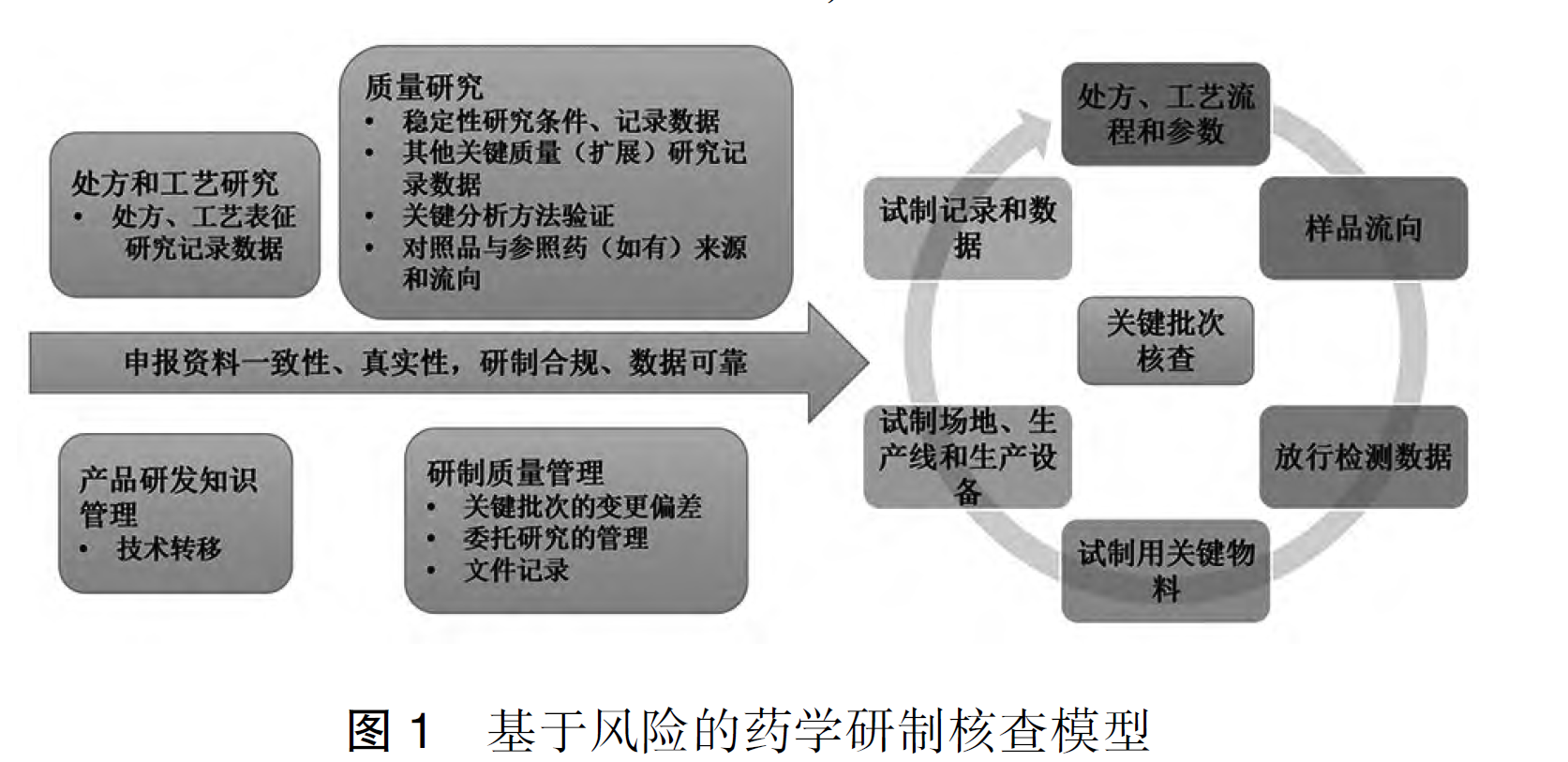
资源分享-生物制品安评批和临床申报批制备的管理
这是一份极其实战的生物制品(疫苗)IND药学开发指南,核心贯穿“关键批次(安评批+IND注册批)必须100%真实、可追溯、风险前控、QbD全程驱动”这一条主线。课件从法规要求入手,引用30号文、IC...
2025病原微生物实验室生物安全管理-附下载地址
课件严格对标《中华人民共和国生物安全法》(2021)、《病原微生物实验室生物安全管理条例》(424号令)、WS233-2017《病原微生物实验室生物安全通用准则》、GB19489-2008《实验室生物安全通用...
202512-加拿大卫生部HC-Guidance on nitrosamineimpurities in medications药物中亚硝胺杂质的风险管控与合规要求-附下载
2025 年 8 月 1 日,加拿大健康部(Health Canada)正式实施了更新后的《药物中亚硝胺杂质指南》,对人用药品、生物制品和放射性药品中的亚硝胺杂质风险评估、检测验证及市场授权变更等提出了全...
资源分享-202512-澳门药监局-生物製品生產質量管理規範
文件是澳门特别行政区政府药物监督管理局 2025 年 12 月 12 日发布的第 05/ISAF/2025 号批示,核准了《生物製品生產質量管理規範》(附录 III),并对原有《藥物生產質量管理規範》补充相关特殊...
资源分享-生物制品工艺研发的管理
这是一份生物制品(疫苗)工艺研发全流程风险管控干货课件,核心贯穿ICH Q8“质量源于设计(QbD)”理念,强调从小试到商业化全程用风险评估、数据积累、异常闭环来构建稳健工艺,确保工艺可重...
资源分享-202501-灭菌设备相关培训
文件是一份灭菌锅 / 灭菌柜相关培训资料,主要围绕设备结构、验证流程及使用注意事项展开,先明确了灭菌锅 / 灭菌柜的定义(密闭锅内高压蒸汽提升温度至 121℃杀灭细菌及芽孢的物理灭菌法)、分...
资源分享-生物制品基于药品生命周期观的系统设计
药品生命周期绝不仅仅是从研发到退市的“时间轴”,更是一条必须用系统化研究和全方位管理串起来的“质量链”,早期任何设计缺陷,后期放大成本都会呈指数级上升,因此从临床前就要按ICH Q8/Q10...














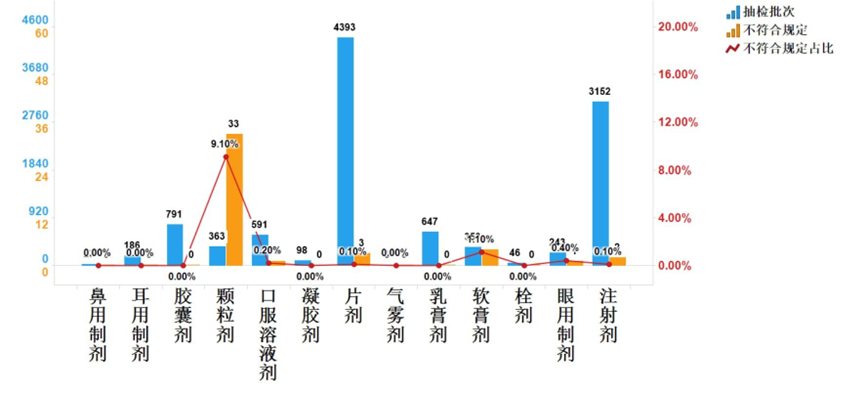





kidzhangy4月前0
感谢分享,楼主好人一生平安Terrific5月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。