排序
资源分享-生物制品基于药品生命周期观的系统设计
药品生命周期绝不仅仅是从研发到退市的“时间轴”,更是一条必须用系统化研究和全方位管理串起来的“质量链”,早期任何设计缺陷,后期放大成本都会呈指数级上升,因此从临床前就要按ICH Q8/Q10...
资源分享0202501-诺和诺德质量体系基础
文件围绕 ICH Q10 药品质量体系展开,先介绍了 ICH 的历史、愿景及相关指南(如 Q8、Q9、Q11 等),明确 ICH Q10 是 2008 年发布的、基于 ISO 质量管理系统且贯穿产品全生命周期(研发、技术转...
资源分享-大湾区202509工艺验证方法与商业规模工艺验证
链接:https://pan.quark.cn/s/1ed1ef0d8efa 药品作为特殊商品,其质量直接关系到患者生命健康。工艺验证作为药品生产质量管理的核心环节,是确保生产工艺稳定可控、产品质量持续合规的关键...
资源分享-病毒性疫苗研发:如何做好进度和质量的平衡
“在资本、监管、竞争的三重高压下,如何既跑出速度、又守住质量底线、不在核查时翻车?”课件以第01章“疫苗研发项目管理”开篇,直击行业现状与痛点(进度永远赶不上老板预期、质量永远被进度...
资源分享-202501消毒剂相关培训
文件为消毒剂相关培训资料,核心围绕消毒剂作用原理与效果确认两大模块展开。在作用原理部分,明确了消毒、灭菌、无菌等关键定义,按氧化类、酚类、醛类、醇类等类别详解其杀菌机理、特点及适用...
资源分享-CFDI20251015生物制品厂房设施设计与风险控制考虑-厂房设施设计中的无菌保障实践-杨冕
在生物制药行业,厂房设施不仅是生产载体,更是产品质量与安全的 “第一道防线”。尤其是抗体药物、ADC 等生物大分子药物,其生产工艺的复杂性、敏感性对厂房设计提出了极高要求 —— 既要满足 ...
20211118-CDE-eCTD专题培训课件
2021年11月18日国家药品审评中心(CDE)主办的“中国eCTD进展情况概述”专题培训会的完整系列材料,共五份PPT,涵盖了eCTD从政策解读、技术规范、实施指南、申报流程到企业最佳实践的全链条内容...
资源分享-20251217-以数据完整性为中心的分析仪器确认和计算机化系统验证思维导图
该思维导图围绕以数据完整性为核心的分析仪器确认与计算机化系统验证展开,聚焦 USP<1058> 标准,涵盖其修订背景、主要变化(如允许合并文档)及对 IQ、OQ、PQ 理解与执行的影响,同时结合 G...
资源分享-20251014CFDI药品注册核查工作流程及相关要求总体介绍-杨敬鹏
在医药行业高质量发展的当下,药品注册核查作为保障药品安全性、有效性和质量可控性的关键环节,其重要性愈发凸显。无论是药品研发企业、注册从业者,还是行业监管相关人员,都需要清晰掌握核查...
资源分享-202512-CDE-放射性新药要学审评中常见问题和考虑-周浩晖
该文件是药审中心化药药学一部 2025 年 12 月发布的关于放射性新药药学审评的专业指引,明确了放射性药品(用于临床诊断或治疗的放射性核素制剂或其标记药物)的发展现状(传统企业与新入局企业...












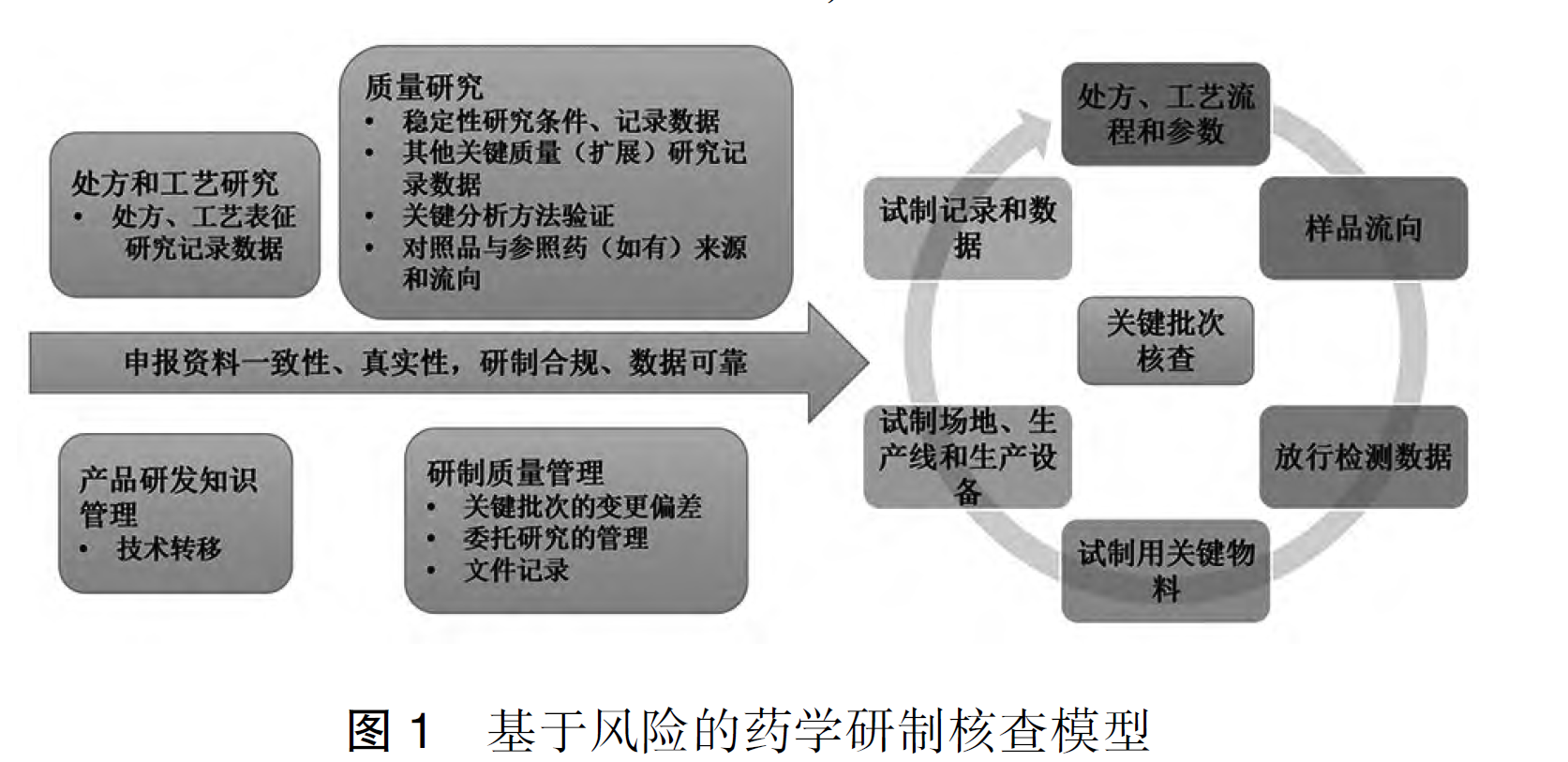


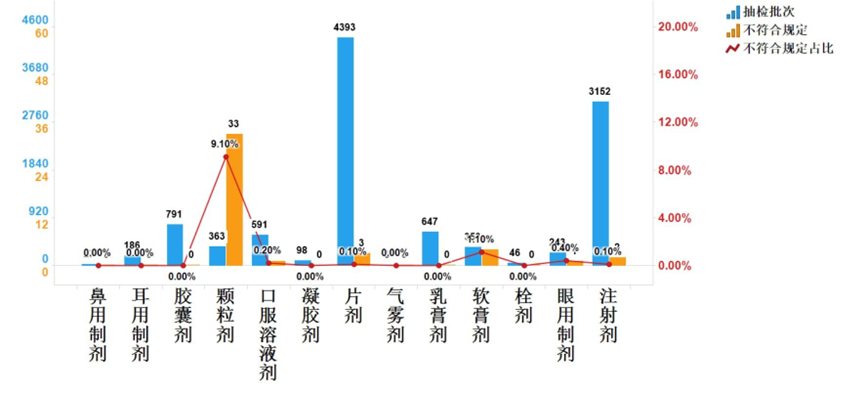




kidzhangy4月前0
感谢分享,楼主好人一生平安Terrific5月前0
感谢!特别有用,资源分享的很及时!北岛2年前0
相当于货架期多久?Mark4年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者5年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。