排序
CDE大湾区-多产品共线生产的风险管理-资料分享
在药品生产领域,多产品共线生产是常见现象,但伴随的污染与交叉污染风险不容忽视。药品审评检查大湾区分中心组织了培训,主要包含以下内容 多产品共线生产风险概述 多产品共线生产风险评...
资源分享-中国仿制药行业发展报告(2025年)
引言 仿制药作为医药工业的重要组成部分,对于降低药品费用、保障药品供应、推动医药产业发展起着至关重要的作用。2025 年《中国仿制药发展报告》的发布,为我们深入了解行业现状、把握发...
国内首个原料药连续制造指南-原料药及中间体连续制造指导原则(附下载)
今天分享一份重磅资料:《原料药及中间体连续制造指导原则》(意见征集稿),这是由中国化学制药工业协会(PIAC)发布的国内首个针对原料药连续制造的行业指南。旨在推动医药工业高端化、智能化...
资源分享-药品检验仪器操作规程及使用指南2019版
书籍介绍:随着药品检验仪器不断发展,以及药品检验实验室质量管理体系曰益完善和药品检验入员能力的不断提高,本书编委会决定本版从名称和内容上相较千上一版进行重要调整。即:仪器操作规程部...
21 CFR Part 312 Investigational New Drug Application (IND)-新药临床试验申请 中英文双语对照
《21 CFR Part 312》是美国食品药品监督管理局(FDA)制定的关于新药临床试验申请 (IND)的管理法规,规定了药物在正式上市前开展临床研究的全过程监管要求。该法规最初于 1987 年发布,...
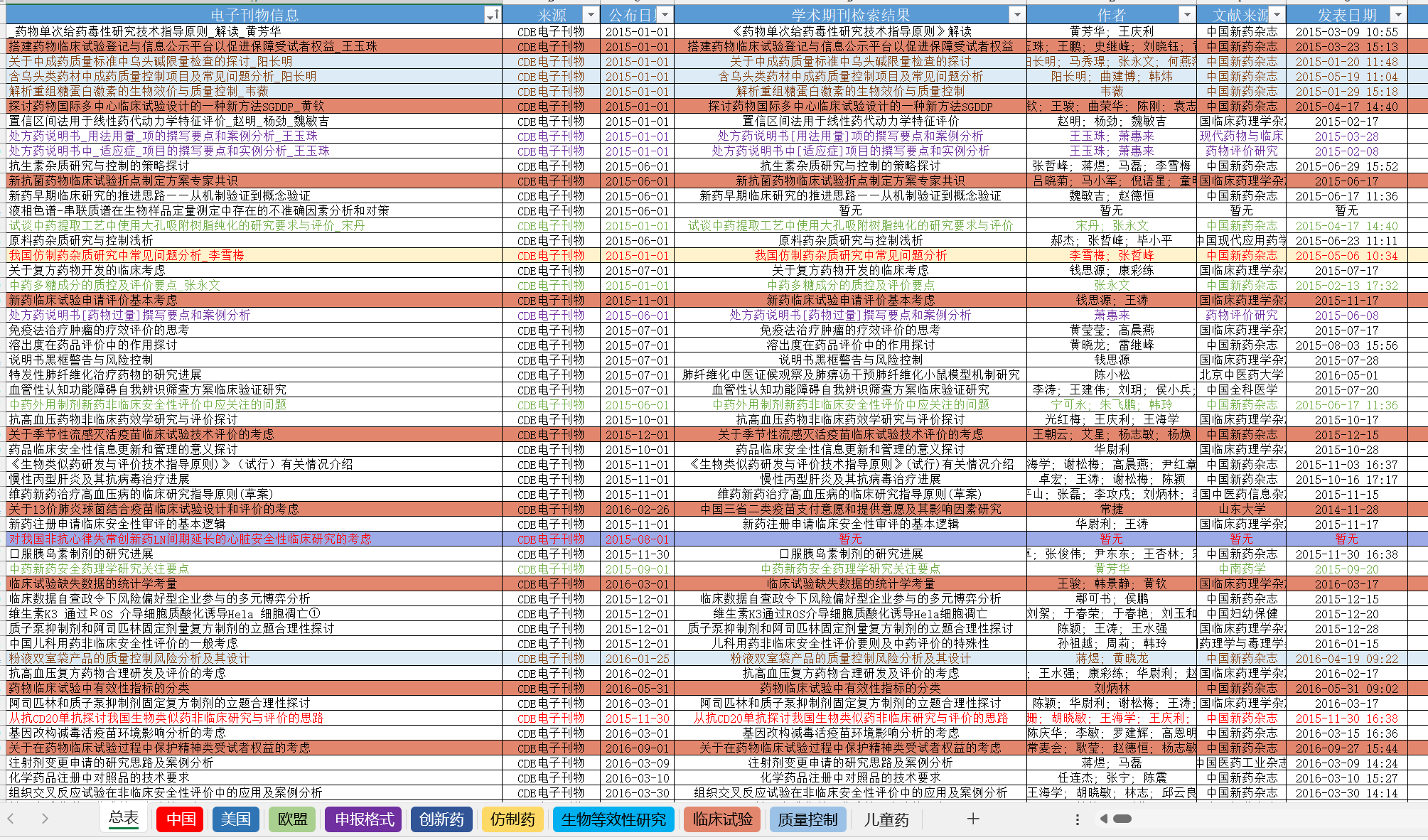
资源分享-CDE电子刊物总览
引言 在药品研发、审评和监管领域,及时获取专业、全面的信息至关重要。今天要给大家分享一份资源 ——CDE 电子刊物总览(2015-至今),这是一个涵盖丰富药品领域知识的信息宝库。 内...
资源分享-山东药监-药品GMP检查手册(上,下)
本书是专为药品GMP检查员、监管人员和药企从业者设计的便携式工具书。它于2021年2月发布,旨在配合新药品管理法的实施,推动药品生产质量管理水平的提升。 上册(法规篇):基础法律法规...
资源分享-APIC 数据完整性问答 第三版 中英文对照(Data Integrity — Frequently Asked Questions (FAQ))
在 GMP/GxP 合规领域,数据完整性(Data Integrity) 一直是监管热点。无论是 FDA、EMA 还是中国 NMPA 的检查中,数据完整性问题频频被点名,稍有不慎就可能导致警告函或停产整改。今天,我为大...
ECA关于审计追踪审查的问答(中英文)-持续更新中(2025.07.16-2025.10.23)
ECA官网从2025.07.16开始陆续更新关于审计追踪审查的问答,目前已经更新到Question 16,本文持续收集更新相关问答,下载地址见下方链接。链接:https://pan.quark.cn/s/f706b57d3d6b 内...



















kidzhangy32天前0
感谢分享,楼主好人一生平安Terrific1月前0
感谢!特别有用,资源分享的很及时!北岛1年前0
相当于货架期多久?Mark3年前2
Thanks for your blog, nice to read. Do not stop.一位WordPress评论者4年前0
嗨,这是一条评论。 要开始审核、编辑及删除评论,请访问仪表盘的“评论”页面。 评论者头像来自Gravatar。